Het gehele genoom screenen voor nieuwe medicijndoelen voor de ZvH.
Wetenschappers screenen het GEHELE genoom om nieuwe potentiële therapeutische doelen voor de ZvH te vinden. Deze ambitieuze studie levert een schat aan gegevens op voor ZvH-onderzoekers
 Geschreven door Dr Rachel Harding 10 april 2020 Bewerkt door Dr Jeff Carroll Vertaald door Esther Arendts Origineel gepubliceerd op 23 februari 2020
Geschreven door Dr Rachel Harding 10 april 2020 Bewerkt door Dr Jeff Carroll Vertaald door Esther Arendts Origineel gepubliceerd op 23 februari 2020
Een recent gepubliceerde studie in het tijdschrift ‘Neuron’ heeft nieuwe potentiële therapeutische doelen voor de behandeling van de ZvH geïdentificeerd. Het werk, uitgevoerd door professor Myriam Heiman en collega’s, gebruikte geavanceerde genetische technologieën en ontdekte dat verschillende genen de progressie van de ZvH in hun modellen in het laboratorium zouden kunnen wijzigen. Veel van deze genen zijn nog niet eerder gelinkt aan de ZvH en zouden interessante nieuwe doelwitten voor onderzoekers kunnen zijn om na te streven bij het ontwikkelen van medicijnen en behandelingen voor de ZvH-patiëntgemeenschap.
Ambitieuze screening van het gehele genoom.
Cellen in onze lichamen bevatten DNA dat voor duizenden genen codeert, elk een recept dat instructies geeft aan onze cellen over hoe zij een verschillend eiwitmolecuul maken. Deze recepten worden gekopieerd vanuit ons DNA in een bericht dat de boodschapper-RNA wordt genoemd. Het RNA wordt vervolgens door cellulaire machines vertaald in eiwitmoleculen. Wetenschappers kunnen deze processen in het laboratorium manipuleren om de rol van verschillende genen in ons lichaam te begrijpen.
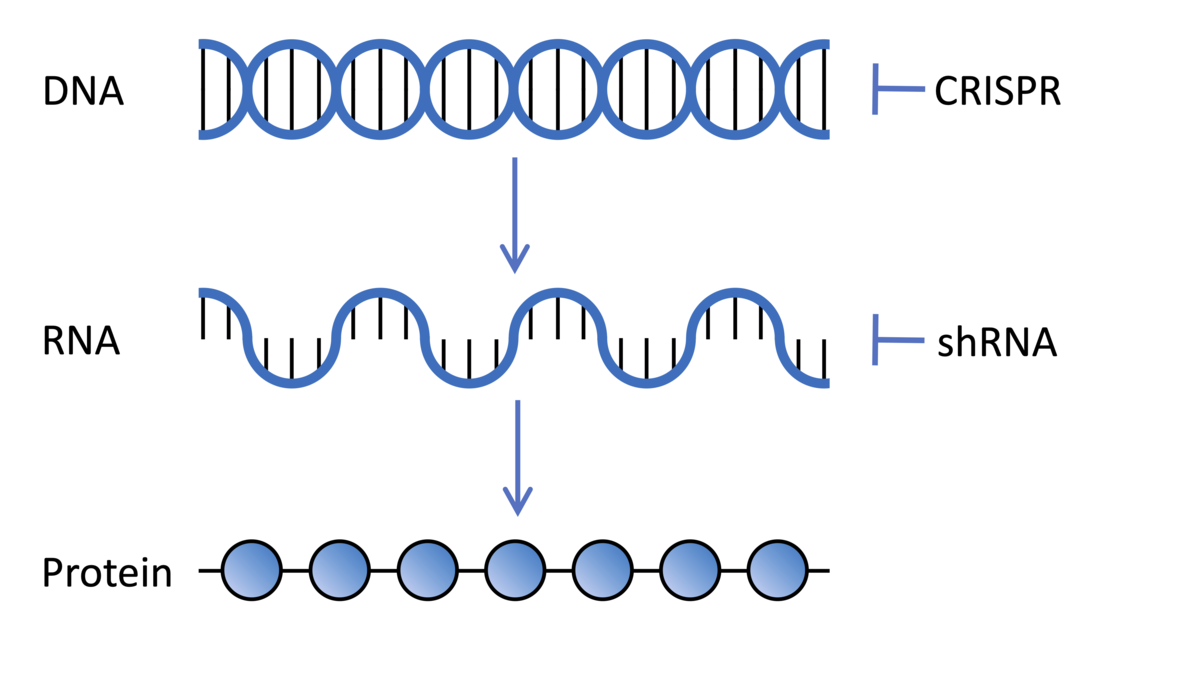
Genetische screenings proberen de rol van een enkel gen in verschillende contexten te begrijpen. In dit geval waren de onderzoekers geïnteresseerd in de rol van alle verschillende genen in onze cellen bij het beschermen tegen de schadelijke effecten van de ZvH-mutatie. Het idee is dus om achtereenvolgens te rommelen met elk afzonderlijk gen om te proberen te ontdekken of dat gen enige invloed heeft op de ZvH-symptomen.
Genetische screening technologieën kunnen op veel verschillende manieren werken, maar ze hebben allemaal als doel om de expressie van eiwitten uit specifieke genen te stoppen of te verlagen. Genen kunnen rechtstreeks worden getarget door het genoom zelf te bewerken. Andere technologieën interfereren met het boodschap-RNA welke is gekopieerd van het gen en welke essentieel is voor de cellen om het eiwit te maken dat het gen codeert.
Dit klinkt misschien bekend bij HDBuzz-lezers aangezien dit vergelijkbare technologieën zijn als die gebruikt worden in huntingtine-verlagende therapieën die momenteel worden onderzocht in diverse klinische trials. Terwijl deze huntingtine-verlagende therapieën zich alleen richten op het huntingtine gen, richten onderzoekers zich in het geval van deze genetische screening op elk gen in het genoom, één voor één, om de rol die zij spelen bij de ZvH uit te werken.
Het Broad Institute, waar professor Heiman is gevestigd, is een wereldleider in het ontwikkelen van bibliotheken die gebruikt kunnen worden voor genetische screenings. In deze studie gebruikten de onderzoekers twee verschillende technologieën in hun screening, die beiden door speciale soorten virussen in de hersencellen worden gebracht. Ten eerste, ‘short-hairpin RNA’s’ die zich richten op het boodschapper-RNA en de expressie van het gen uitzetten door onderbreking van de vertaling van de boodschap in het functionele eiwit molecuul. Ten tweede werd CRISPR gebruikt om de gensequentie in het genoom direct te bewerken, waardoor het vermogen om aan te gaan en eiwitten te maken, verstoord wordt
Systematische genetische screenings in verschillende diermodellen bestaan al tientallen jaren voor meer eenvoudige systemen zoals wormen en vliegen. Echter, dit soort experimenten waren technisch veel uitdagender om uit te voeren voor de hersenen van zoogdieren, wat een belemmering is geweest voor wetenschappers die geïnteresseerd waren in het uitvoeren van deze screenings om verschillende neurodegeneratieve ziekten te begrijpen.
Prof. Heiman’s team was in staat om deze moeilijkheden te overwinnen door een manier te vinden om de reageermiddelen samen te voegen en te concentreren die bij een genetische screening in het brein van muizen wordt geinjecteerd. Ze waren ook in staat om rechtstreeks het striatum te bereiken, een breingebied waarin zij geinteresseerd waren. Het striatum is het zwaarst getroffen hersengebied in ZvH-patiënten, en dat is waarom dit gebied was gekozen.
20,000+ genen werden onderzocht in deze ene studie.
In plaats van te kijken naar bekende genen die geassocieerd zijn met neurodegeneratie in hun muismodellen, namen de wetenschappers in deze studie een onbevooroordeelde benadering en voltooiden ze een genoom-brede screening om te kijken naar de rol van bijna elk gen. In feite hebben ze bijna alle van de circa 22,000 genen in muizen gescreend. Dit was een ongelofelijk ambitieuze benadering en verschaft een schat aan data voor onderzoekers in het ZvH veld en daarbuiten.
Aangezien dit de eerste systematische screening was van alle genen in het centrale zenuwstelsel van zoogdieren, gebruikten de onderzoekers normale muizen zonder bekende mutatie om uit te zoeken welke genen belangrijk zijn voor de overleving van hersencellen onder normale omstandigheden. Genen die eerder waren geïdentificeerd in systematische screenings in eenvoudigere modellen zoals vliegen en wormen, bleken ook belangrijk te zijn bij muizen.
In deze studie werden echter veel nieuwe genen geïdentificeerd, waaronder verschillende die een rol spelen bij het metabolisme in cellen. Deze werden niet eerder geïdentificeerd in andere systematische screenings in vliegen of wormen, waarschijnlijk omdat het centrale zenuwstelsel van zoogdieren meer energie nodig heeft en afhankelijker is van genen die cellen helpen energie te maken. Deze bevindingen zijn een goede herinnering aan hoe belangrijk het is voor wetenschappers om hun onderzoeksresultaten te overwegen in de context van de onderzochte diermodellen.

Naast het controle muismodel werden er twee verschillende ZvH-muismodellen gebruikt in dit experiment, R6/2 en zQ175, die beiden uitgebreid worden beschreven in de ZvH-onderzoeksliteratuur. Door het vergelijken van de genen in de screening van de ZvH-muismodellen met die van de controle muizen konden wetenschappers bepalen welke genen specifiek belangrijk waren voor de ZvH, in plaats van de genen die hersencelfunctie in het algemeen beïnvloeden.
Voor de genetische screenings die werden uitgevoerd op de twee ZvH-muismodellen gebruikt in het onderzoek, werden ongeveer 500 genen geïdentificeerd als zijnde belangrijk bij de progressie van de ZvH. Veel van deze genen spelen een rol in paden die wetenschappers eerder hebben geïdentificeerd in andere onderzoeken, zoals de genoom-brede associatiestudies (GWAS) die naar genen zochten die de leeftijd kunnen beïnvloeden waarop ZvH symptomen optreden in menselijke patiënten. Deze omvatten genen die betrokken zijn bij herstelroutes voor DNA-schade die de integriteit van ons genetisch materiaal behouden, evenals genen in transcriptiewegen die reguleren hoe de boodschapper-RNA in cellen wordt verwerkt en dus welke eiwitmoleculen worden gemaakt.
Er werden ook nieuwe genetische doelwitten geïdentificeerd in de screenings, waaronder genen behorende bij de Nme-familie. Van Nme genen is eerder vermeld dat zij gelinkt zij aan verspreiding in sommige vormen van kanker, maar dit is de eerste keer dat zij verbonden zijn met de ZvH. Heimand en collega’s denken dat het richten op de Nme route belangrijk kan zijn bij het ondersteunen van hersencellen bij het verwijderen van het mutant huntingtine-eiwit in ZvH-hersenen. Als we medicijnen kunnen ontwerpen die deze route kan beïnvloeden, kan dit een potentiële manier zijn om de ZvH te helpen behandelen.
Nieuwe aanknopingspunten voor het maken van nieuwe ZvH-medicijnen.
Zelfs met veel baanbrekende klinische onderzoeken die gaande zijn om verschillende therapieën voor ZvH-patiënten testen, is het belangrijk dat onderzoekers blijven zoeken naar alternatieve manieren om mogelijk nieuwe medicijnen voor de ZvH te maken. Dit onderzoek biedt een schat aan data over de ZvH aangezien het werkt in hersenen van muismodellen en ons ideeën geeft over nieuwe doelwitten die moeten worden nagestreefd als potentiele medicijn doelwitten. Deze kunnen op een dag terecht komen in de pijplijn voor het ontdekken van geneesmiddelen. Het zal spannend zijn om te zien hoe deze nieuwe aanknopingspunten worden opgevolgd door onderzoekers over de hele wereld en ook hoe deze technologie kan worden toegepast op andere neurodegeneratieve ziekten.


