Gen-silencing voor Huntington: het verhaal tot nu
Is gen-silencing het wondermiddel voor Huntington? Wat brengt de toekomst?
 Geschreven door Professor Ed Wild 1 augustus 2011 Bewerkt door Dr Jeff Carroll Vertaald door Jaco Wessels Origineel gepubliceerd op 22 maart 2011
Geschreven door Professor Ed Wild 1 augustus 2011 Bewerkt door Dr Jeff Carroll Vertaald door Jaco Wessels Origineel gepubliceerd op 22 maart 2011
Gen-silencing betekent dat met speciale moleculen het signaal wordt uitgezet dat de cel aanzet tot het maken van het schadelijk Huntingtin. Dit HDBuzz gen-silencing artikel gaat over de techniek, de dusver behaalde resultaten de te nemen hordes.
We kregen veel vragen van lezers om een artikel te schrijven over ‘gen-silencing’ (letterlijk ‘het laten zwijgen van genen’) - oftewel ‘Huntingtin-silencing’. Het is een onderwerp dat veel stof doet opwaaien. Veel aandacht werd getrokken door een persbericht van Lundbeck en de Universiteit van Massachusetts die willen samenwerken aan de ontwikkeling van RNA interferentie (RNAi) als therapie voor de ziekte van Huntington.
Dus, wat is gen-silencing? Hoe werkt het? Wat is het nut voor Huntington patiënten?

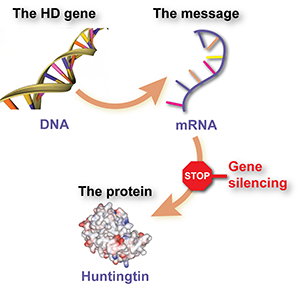
Genen, boodschappers en eiwitten
Eiwitten zijn moleculen die veel nuttige werk doen in cellen - zoals het laten lopen van allerlei chemische reacties, signalen doorgeven, structuur geven aan de cellen, enzovoort. Elke eiwit wordt gemaakt volgens een instructieboekje wat we een gen noemen. Genen zijn gemaakt van DNA en zitten in de controlekamer van de cel, de celkern of nucleus.
Genen worden niet rechtstreeks gebruikt om eiwitten te maken. Als tussenstap maakt de cel van het DNA een proefdruk. Dit wordt ‘messenger-RNA’ (mRNA) genoemd en het is als het ware een ‘boodschapper molecuul’. Dit mRNA wordt op zijn beurt gebruikt om aan de cel door te geven uit welke bouwstenen een bepaalde eiwit bestaat.
Samenvattend, DNA dient als voorbeeld voor mRNA, en dit ‘boodschapper molecuul’ wordt gebruikt om eiwitten te maken.
De ziekte van Huntington wordt veroorzaakt door een afwijkend gen - het gen dat als basis dient om een eiwit te maken dat Huntingtin heet. Van elk gen heeft de cel een setje van twee. De meeste mensen met Huntington en zij die het later ontwikkelen, hebben een ‘normaal’ gen en één die te veel herhalingen heeft van een bepaald bouwsteen. Dat bouwsteen duiden we aan met de drie letters ‘CAG’. Deze ‘spelfout’ in het DNA van het gen zorgt ervoor dat er Huntingtin gemaakt wordt die zich anders gedraagt dan het normale Huntingtin. Hierdoor beschadigen de cellen en worden de symptomen van de ziekte van Huntington veroorzaakt.
De term ‘wild-type’ wordt gebruikt voor het niet gemuteerde of ‘normale’ gen en eiwit.
Het Huntingtin gen laten zwijgen
Het afwijkende gen is de veroorzaker van alle problemen bij de ziekte van Huntington. Waarom kunnen we het niet gewoon vervangen door een gezond gen? Helaas werkt dat niet omdat cellen van nature een goed systeem hebben om hun DNA, wat veilig in de celkern zit, te beschermen tegen invloeden van buitenaf.
Daarentegen zwerft het boodschapper molecuul, mRNA, vrij door de cel en geeft signalen door om het foute eiwit te maken. Als we het voor elkaar krijgen het mRNA het zwijgen op te leggen en de cel het signaal te laten negeren, dan wordt het foute eiwit niet gemaakt. Dat is het principe van ‘gen-silencing’. De gedachte is dat wetenschappers een molecuul maken dat aan de Huntingtin boodschapper plakt om zo te voorkomen dat het signaal aan de cel wordt doorgegeven.
Gen-silencing klinkt té mooi om waar te zijn. Maar dat is het niet! In 1998 hebben twee wetenschappers, Nobelprijs winnaars, een manier gevonden om genen ‘uit’ te zetten. Zij noemden hun techniek RNA interferentie (RNAi).
Gen-silencing is nu een veel gebruikte techniek om the bestuderen hoe precies ziektes schade veroorzaken en om behandelingen voor die ziektes te ontwikkelen. Een gen-silincing medicijn (Vitravene, een middel om ooginfecties te behandelen) is nu toegestaan voor gebruik bij mensen. Tientallen anderen medicijnen voor verschillende ziektes zijn nu al in testfase.
Als het zo eenvoudig is als het klinkt, waarom hebben we dan nog geen gen-silencing pilletje voor de ziekte van Huntington? Nou, zoals altijd bij de ontwikkeling van nieuwe medicijnen zijn er onvoorziene problemen, teleurstellingen en uitdagingen.
Uitdaging 1: In de hersenen komen
Eén van de grootste uitdaging is om het medicijn daar te krijgen waar je het nodig hebt. Bij de ziekte van Huntington sterven hersencellen (neuronen) af. Dus we moeten het medicijn in die cellen zien te krijgen.
“Verscheidene teams hebben op basis van dierproeven succes gemeld in verlaging van het Huntingtin gehalte ”
De vraag is hoe je het medicijn in de hersenen krijgt. De hersenen hebben een natuurlijke bescherming om te voorkomen dat er allerlei schadelijke stoffen vanuit het bloed binnenkomen. Dat is natuurlijk heel mooi, want het beschermt de hersenen, maar voor de Huntington onderzoekers is het een kopzorg. Het is veel moeilijker om het medicijn de hersenen in te krijgen, dan bijvoorbeeld in de lever of de nieren.
Hierdoor is het onwaarschijnlijk dat een simpel pilletje of injectie gaat werken bij Huntington patiënten. Het probleem is te omzeilen door gebruik te maken van pompjes en kleine buisjes om het silencing medicijn direct in de hersenen of hersenvocht te brengen. Dat klinkt niet erg bemoedigend en ongetwijfeld is het implanteren van pompjes en buisjes in de hersenen niet eenvoudig. Toch worden dergelijke technieken nu al succesvol gebruikt bij andere ziektes, zoals multiple sclerose (MS) en hersenkanker.
Uitdaging 2: Verspreiding
Als het medicijn ergens lokaal in de hersenen is, dan moet het door heel de hersenen verspreid worden. De hersenen zijn een dichte bal weefsel en het is niet eenvoudig om het silencing medicijn evenredig te verspreiden. Daar komt nog bij dat het medicijn echt in de hersencellen moet komen - het is niet voldoende als het de cellen alleen maar omspoelt.
Er zijn verschillende technieken om dit probleem op te lossen. De eerder genoemde Nobelprijs winnaars wilden met RNA interferentie moleculen (RNAi) de genen ‘uit’ zetten. Deze moleculen lijken erg veel op natuurlijke moleculen die door de cel geproduceerd worden. Het nadeel is dat RNAi moleculen niet echt gemakkelijk door de hersenen verspreiden en ook niet eenvoudig in de cel komen.
Ze gebruikten daarom hele kleine buisjes. Die werden in de hersenen geplaatst waar het weefsel het meest aangetast was. De buisjes werden verbonden met pompjes en met een lichte druk werd het in de hersenen verspreid. Een andere mogelijkheid is om de RNAi moleculen mee te laten liften met onschadelijk gemaakte virussen, die erg goed zijn te verspreiden en ook gemakkelijk de cel in gaan.
Een derde benadering is om andere moleculen te proberen die beter zijn in het verspreiden en het binnendringen van de cellen. Anti-sense Oligonucleotides (ASOs) lijken erg veel op RNAi moleculen, maar zijn simpeler en worden niet door de cel geproduceerd. Het principe blijft hetzelfde - ze plakken aan de mRNA boodschapper en voorkomen dat de cel het foute eiwit gaat produceren.
ASOs blijken veel gemakkelijker te verspreiden en in de cel door te dringen. Bovendien hebben ze een langere levensduur - wat goed of slecht kan zijn, afhankelijk van hoe goed ze hun werk doen.
Welke gen-silencing techniek is beter? We weten het niet, vandaar dat het onderzoek gericht is op zowel RNAi als ASOs om te kijken welke het beste is.
Uitdaging 3: Het gen ‘uit’ zetten
Essentieel is of het gen-silencing medicijn inderdaad in staat is het gen in de ‘uit’ stand te zetten. In dierproeven lijkt het er sterk op dat dit gaat lukken met zowel RNAi als ASO behandelingen.
In 2005 injecteerden onderzoekers onder leiding van Bev Davidson in Iowa, RNAi moleculen in de hersenen van Huntington muizen en zagen 85% afname van het Huntingtin eiwit. De behandeling kwam ten goede aan de motoriek en verminderde de afwijkingen in de cellen van de muizen. Sindsdien hebben verschillende teams successen gerapporteerd in het terugbrengen van het Huntingtin eiwit door gebruik te maken van verscheidene moleculen, zowel met RNAi als ASO behandelingen. Recent onderzoek toont aan dat verbeteringen van deze relatief korte behandelingen ook nog behoorlijk lang aanhouden.
Uitdaging 4: Het juiste doel kiezen
Onderzoekers zien liever van te voren de problemen dan dat ze de problemen gaandeweg tegenkomen. Een mogelijk probleem met gen-silencing is het effect op het natuurlijke of wild-type Huntingtin gen.
We weten dat het volledig ontbreken van het Huntingtin gen niet goed is. Muizen zonder dit gen sterven al voordat ze geboren zijn. De vraag is of de reductie van het foute Huntingtin een gevaarlijk effect heeft op het goede, de wild-type, Huntingtin.
Op dit moment weten we dat niet. Sommigen denken dat een kleine afname van het foute Huntingtin al voldoende is voor de cellen om te herstellen en dat er daarom geen reden tot ongerustheid is als het wild-type Huntingtin ook iets afneemt. Anderen denken dat we iets moeten ontwikkelen wat alleen het foute Huntingtin uitschakelt. Dat wordt allel-specifiek silencing genoemd - elke afzonderlijke kopie van het gen wordt een allel genoemd.
Allel-specifiek silencing klinkt erg logisch - waarom zouden we ons niet alleen richten op het gemuteerde gen? Het nadeel daarvan is je dan naar het specifieke DNA van elke afzonderlijke patiënt moet kijken. Het gaat om de ‘spelling verschillen’ tussen de twee allelen. Gelukkig zijn die verschillen er meestal, maar omdat het verschil voor elke patiënt anders is, hebben dan ook verschillende medicijnen nodig om zoveel mogelijk patiënten te helpen. Bovendien zijn er patiënten die helemaal geen ‘spelling verschillen’ hebben om een dergelijke allel-specifieke behandeling mogelijk te maken.
De discussie over de noodzaak van allel-specifiek silencing is volop gaande. Het goede nieuws is dat we niet op de uitkomst daarvan hoeven te wachten. Aan beide technieken wordt momenteel gewerkt door verschillende onderzoek teams.
Uitdaging 5: Bijwerkingen
Zelfs al wordt het probleem van de afname van wild-type Huntingtin opgelost, gen-silencing behandelingen kunnen de nodige bijwerkingen hebben.
Eén probleem is het zogenoemde ‘off target effect’, waar het medicijn naast de boodschapper voor Huntingtin ook andere boodschapper moleculen uitschakelt. Dat kan verschillende bijwerkingen veroorzaken.
Een ander probleem zou kunnen zijn dat het immuun systeem reageert op het medicijn en dat daardoor de zaak alleen maar erger wordt.
Al deze bijwerkingen moeten we serieus nemen nu we nog in de fase van dierproeven zitten. De meest onschuldig lijkende bijwerking kan einde verhaal betekenen omdat mensen met de ziekte van Huntington waarschijnlijk gedurende een lange periode met gen-silencing behandeld worden.
Wetenschappers werken aan de beste moleculen met de laagste kans op bijwerkingen en alleen de veiligste kunnen worden gebruikt voor mensen.
Wanneer, wanneer, wanneer?
Het optimisme rond gen-silencing is terecht. Veel onderzoekers denken dat dit de beste kans is op een succesvolle behandeling van de ziekte van Huntington. Maar er zijn duidelijk nog veel zaken die opgelost moeten worden. Toch wordt er elk jaar vooruitgang geboekt en iedereen is het ermee eens dat geen van de problemen onoverkomelijk lijkt.
Op dit moment wordt er een ASO gen-silencing behandeling getest bij ALS patiënten (motorische neurologische ziekte). Ook voor Huntington is dat onderzoek belangrijk, want niet alleen het medicijn wordt getest. Men test ook het systeem van pompjes en buisjes om het medicijn daar te krijgen waar het moet zijn. Ondertussen zoeken vele onderzoekers naar het molecuul wat het beste werkt bij Huntington patiënten.
We weten het niet zeker wanneer gen-silencing behandelingen beschikbaar zijn voor patiënten, maar HDBuzz zou teleurgesteld zijn als we niet spoedig de eerste testen bij mensen zien.


