Heroriëntering van het huntingtine eiwit in cellen
Canadees team decodeert labels die in cellen huntingtine eiwit heroriënteren en helpt verklaren hoe het toxisch wordt
 Geschreven door Dr Jeff Carroll 5 november 2011 Bewerkt door Professor Ed Wild Vertaald door Vik Hendrickx Origineel gepubliceerd op 26 juni 2011
Geschreven door Dr Jeff Carroll 5 november 2011 Bewerkt door Professor Ed Wild Vertaald door Vik Hendrickx Origineel gepubliceerd op 26 juni 2011
Het gemuteerde huntingtine eiwit veroorzaakt de ZvH maar is niet altijd even toxisch. De exacte locatie van het eiwit in de cellen heeft een grote invloed op de vraag of cellen er mee kunnen omgaan. Nieuw onderzoek helpt bij het begrijpen van de signalen die het gemuteerde huntingtine aansturen, en geeft aanwijzingen om het minder toxisch te maken.
Huntingtine en zijn slechte tweelingbroer
Hoewel de ziekte van Huntington te wijten is aan een genetische afwijking, weten we dat schade aan cellen wordt veroorzaakt door het gemuteerde huntingtine eiwit. Het Huntington gen bevat een reeks instructies voor het maken van het huntingtine eiwit. Bij mensen die de ZvH hebben of die drager zijn van het afwijkende gen, heeft een “spellingsfout” aan het begin van de genetische instructie tot gevolg dat een specifiek deel van het eiwit langer is dan normaal.Een teveel aan bouwstenen die men “glutaminen” noemt klonteren samen aan één uiteinde van het eiwit.

Teveel glutaminebouwstenen aan het uiteinde van het eiwit heeft rampzalige gevolgen en is verantwoordelijk voor het schadelijk effect van het gemuteerde huntingtine.
Een van de belangrijkste opdrachten van ZvH onderzoekers is om te achterhalen hoe het gemuteerde eiwit zich onderscheidt van het normale eiwit, en hoe dit tot schade leidt in de cellen. Elk nieuw stukje informatie over de manier waarop het eiwit schade veroorzaakt is een mogelijke bijdrage in het onderzoek naar behandelingen die de ziekte vertragen.
Ray Truant is een ZvH onderzoeker van de McMaster Universiteit uit Ontario, Canada. Truant en zijn team wetenschappers hebben het huntingtine eiwit gedurende vele jaren bestudeerd en hebben bijgedragen tot belangrijke inzichten in de werking van het eiwit en wat misgaat bij de ziekte van Huntington.
Het N-terminale fragment
Huntingtine is een lang eiwit en dat maakt het moeilijk om het als een geheel te bestuderen. Het gen werd in 1993 ontdekt en het werd al snel duidelijk dat het meest schadelijke onderdeel ervan zich bevindt aan het begin van het gemuteerde eiwit. Wetenschappers noemen dit stukje huntingtine met de extra glutamine, ‘het N-terminale fragment’.
Naast dit kritisch gebied met de Huntington mutatie bevat het N-terminale fragment van het huntingtine eiwit een aantal andere interessante functies. Wetenschappers bestuderen het nu al bijna 20 jaar en vinden in dit kort stukje eiwit nog altijd onverwachte eigenschappen die een grote invloed uitoefenen op de cellen.
Bagageafhandeling in cellen
Aminozuren zijn de bouwstenen van een eiwit. Truant’s laboratorium had reeds ontdekt dat de eerste zeventien aminozuurbouwstenen van het huntingtine eiwit belangrijk zijn. Ze gedragen zich een beetje als een ‘adreslabel’ voor het hele eiwit.
Afhankelijk van wat in de cel gebeurt worden kleine chemische “labels” ofwel gehecht aan ofwel verwijderd van de eerste zeventien aminozuren. Het transportsysteem in de cellen kan deze labels vervolgens lezen als een barcode.
Afhankelijk van het patroon van de aanwezige labels wordt het huntingtine eiwit verplaatst naar andere locaties in de cel. Dus, ondanks het feit dat deze zeventien aminozuren slechts een klein gedeelte van het hele huntingtine eiwit vormen, kunnen ze een enorme impact hebben op de locatie en functie van het eiwit.
“Specifieke tags op het dertiende en zestiende aminozuur van huntingtine helpen bij het bepalen of het eiwit al of niet terecht komt in de kern. ”
Het toevoegen en verwijderen van deze kleine labels heet “posttranslationele modificatie”. “Translatie” is het proces van opbouw van eiwitten in overeenstemming met de DNA code van een gen, dus ‘posttranslatie’ betekent gewoon ‘nadat het eiwit is gebouwd’.
De magische getallen: dertien en zestien.
Het begrijpen van posttranslationele modificatie is echt belangrijk bij de ZvH omdat het de schadelijke effecten van het eiwit lijkt te beïnvloeden. In 2009 bijvoorbeeld, ontdekte de groep van William Yang van het UCLA dat men - door toevoegen van twee labels - kon voorkomen dat Huntington model muizen de ziekte ontwikkelden. Deze labels werden aan de dertiende en zestiende aminozuurbouwsteen van het huntingtine eiwit gehecht.
Aangezien deze twee chemische labels cruciaal lijken voor de toxische effecten van het mutant huntingtine eiwit, is het belangrijk om ze meer in detail te begrijpen. Het team van Truant stelde zich tot doel om het effect te bepalen van deze twee labels op de eindlocatie van het eiwit en op de schade die het veroorzaakt als het daar is aangekomen.
Wat ontdekten ze?
Eerst bestudeerden de wetenschappers het eiwit in levende cellen die groeiden in een schaaltje in het laboratorium. Zij veranderden de cellen genetisch zodanig dat ze enkel de eerste zeventien aminozuurblokken van het huntingtine eiwit aanmaakten, en noemden dit N17. Het N17 huntingtine fragment werd geënt op een eiwitsubstraat dat geel oplicht. Hierdoor kon het N17 fragment geobserveerd worden terwijl het zich verplaatste in de cel.
Truant en zijn team ontdekten dat als het korte huntingtine fragment gelabeld werd op de dertiende en zestiende bouwsteen het veel waarschijnlijker werd dat het zou terecht komen in de kern van de cellen.
De kern is een echt belangrijk onderdeel van de cel - het DNA wordt er opgeslagen, gekopieerd en gelezen. Veel onderzoekers hebben gesuggereerd dat huntingtine toxischer is als het zijn weg vindt naar de celkernen. Maar het kan ook schade berokkenen als het zich buiten de kern bevindt, het is dus belangrijk te onderzoeken waar het eiwit het meest schadelijk is.
Het team ging verder, en toonde aan dat huntingtine te vinden is op zeer specifieke locaties binnen de kern. Ze ontwikkelden ook nieuwe technieken om enkel de gelabelde versies van het eiwit te observeren in plaats van alle niet-gelabelde rondzwevende exemplaren. Deze hulpmiddelen zullen zeer nuttig zijn voor studies die in de toekomst de rol van dit labelingproces in de ZvH zullen onderzoeken.
Aangaande geneesmiddelen?
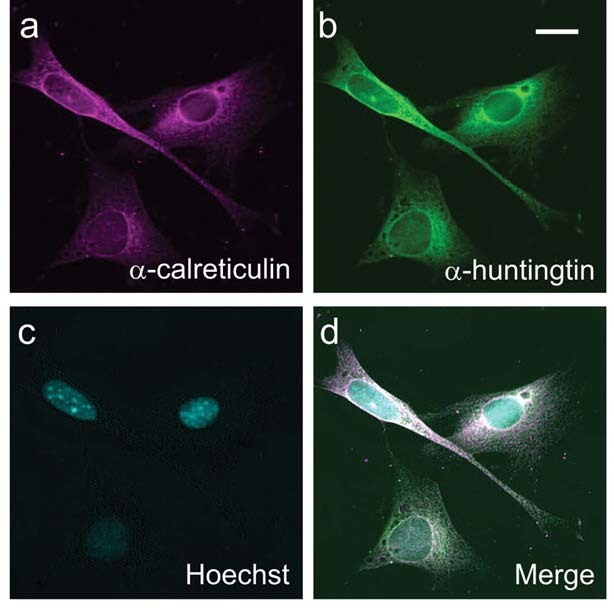
Dit werk toont aan dat specifieke labels op het dertiende en zestiende aminozuur van het huntingtine mede bepalen of het eiwit in de celkern terecht komt of niet. Het leidt tot het idee dat geneesmiddelen die de labeling van aminozuren wijzigt in staat zouden kunnen zijn om schade aan cellen te beperken.
Hoe zou zo'n geneesmiddel werken? Of, om het in de taal van de geneesmiddelenmakers te zeggen, wat zou het “doelwit” zijn?
Wel, de chemische labels worden aan het huntingtine gehecht door eiwitmachines die men “kinasen” noemt, en ze worden ervan verwijderd door andere machines, “fosfatasen” genoemd. Kinasen lijken een beetje op nietmachines, fosfatasen op nietjesverwijderaars.
Volgens de benadering van Truant zouden geneesmiddelen die de activiteit van het “kinase” nietapparaat verminderen, ook de labels op het huntingtine moeten verminderen zodat dit wegblijft uit de celkern. De volgende stap zou zijn om uit te zoeken waar het eiwit dan wel terecht komt, en of het meer of minder toxisch is geworden.
Om deze aanpak te testen gebruikte Truant’s team meerdere geneesmiddelen waarvan bekend is dat zij kinasen als doelwit hebben. Deze “kinaseremmende” chemische stoffen kunnen wetenschappers helpen bij het achterhalen welk eiwit een bepaalde kinase bij voorkeur labelt. Door het blokkeren van een welbepaald kinase en vervolgens gebruik te maken van de hulpmiddelen die ze hebben ontwikkeld om naar het gelabelde huntingtine te kijken, kunnen de onderzoekers vaststellen welke kinasen de labeling uitvoeren.
Na het testen van geneesmiddelen die tachtig verschillende kinasen blokkeerden, ontdekte het team dat één bepaalde kinase nl. ‘caseïne kinase2’- of ‘CK2’ -bijzonder belangrijk is. Zoals verwacht hadden geneesmiddelen die CK2 blokkeerden tot gevolg dat huntingtine veel minder gelabeld werd op de cruciale uiteinden. Huntingtine werd uit de celkern gehouden en in plaats daarvan werd het naar de “eiwitfabriek” van de cel, het endoplasmatisch reticulum of “ER” gestuurd. Gedurende dat proces vergrootte de schade die door het eiwit werd aangericht.
Wacht, maakten zij het eiwit meer toxisch?!
Een geneesmiddel dat huntingtine toxischer maakt is natuurlijk net het tegenovergestelde van wat wij willen bereiken bij mensen. Haast je dus niet naar de apotheek om een fles CK2-remmers te kopen.
Als dit werk moet leiden tot behandelingen voor patiënten met de ziekte van Huntington dan willen we meer gelabelde huntingtine, niet minder. In dit vroege stadium trachtte Truant’s team enkel het meest krachtige doelwit te achterhalen. Verder werk kan nu aangevat worden om meer inzicht te krijgen in processen die het omgekeerde effect veroorzaken en huntingtine minder toxisch maken.
Dit werk - dat uitgevoerd wordt op cellen in een schaaltje - is nog ver weg van nieuwe behandelingen voor patiënten, maar het is een belangrijke stap voorwaarts. Het verhoogt ons begrip over een van de belangrijkste spelers die schade veroorzaken aan cellen, en opent een nieuwe weg voor onderzoekers die werken aan toekomstige behandelingen.