Een recentere versie van het artikel is beschikbaar maar is nog niet vertaald.
We werken aan de vertaling van dit artikel. Als alternatief kunt u het artikel lezen in Engels en Duits
Huntington’s disease therapeutics conference 2022 - Dag 1
Bekijk de onderzoeksupdates van dag 1 van de HD Therapeutics Conference in 2022 #HDTC2022


 Geschreven door Dr Rachel Harding, Dr Leora Fox, Dr Sarah Hernandez en Joel Stanton 4 april 2022 Bewerkt door Dr Sarah Hernandez Vertaald door Vik Hendrickx Origineel gepubliceerd op 3 maart 2022
Geschreven door Dr Rachel Harding, Dr Leora Fox, Dr Sarah Hernandez en Joel Stanton 4 april 2022 Bewerkt door Dr Sarah Hernandez Vertaald door Vik Hendrickx Origineel gepubliceerd op 3 maart 2022
Goedemorgen vanuit het zonnige Palm Springs! Na een COVID-onderbreking van 2 jaar staat de ZvH Therapeutic Conference er weer - de grootste jaarlijkse bijeenkomst van ZvH-onderzoekers! Onze Twitter-updates zijn hieronder samengevat. Blijf live updates volgen voor de rest van de conferentie met de hashtag #HDTC2022.
Op dag 1 komen onderzoeksupdates van ‘s werelds beste ZvH-laboratoria aan bod.
Huntingtine-eiwit bouwstenen
Dr. Paolo Beuzer (CHDI) en Dr. Vanessa Wheeler (MGH) introduceren de eerste sessie gesprekken handelend over manieren om CAG-herhalingen in huntingtine-DNA en -RNA te bestuderen en mogelijk te manipuleren.
CAG-herhalingen complexer dan gedacht
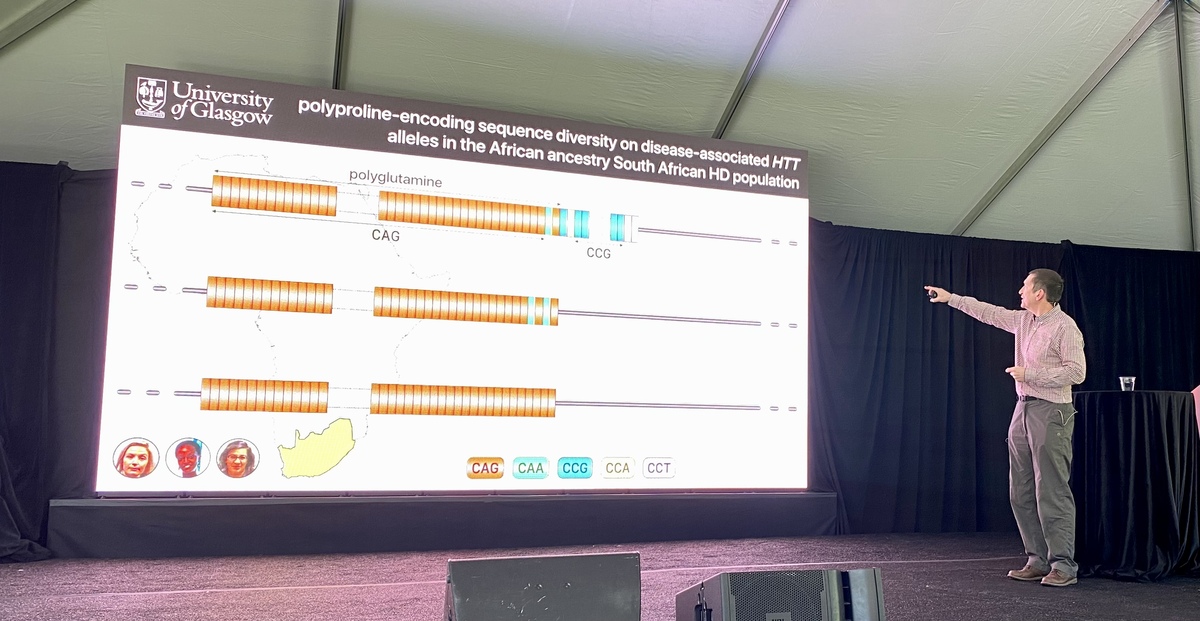
De eerste spreker van de dag is Darren Monckton van de University of Glasgow. Het Monckton-lab doet onderzoek naar de herhalingen in de DNA-sequentie bij ziekten zoals de ZvH.
Hoewel de CAG-combinatie eenvoudig lijkt omdat zij zo kort is, is zij eigenlijk best ingewikkeld. Het aantal CAG-herhalingen alleen is niet bepalend voor de leeftijd waarop iemand ZvH-symptomen zal ontwikkelen. CAG codeert voor glutamine, een eiwitbouwsteen. Maar ook andere lettercombinaties kunnen hiervoor coderen. Eén daarvan is CAA, dat ook kan bijdragen aan de polyglutaminen van de ZvH. Ontbrekende CAA-herhalingen kunnen ook van invloed zijn op de leeftijd waarop iemand symptomen krijgt.
CAA onderbrekingen zijn zeldzaam. In vergelijking met personen met een zuivere CAG-reeks komt de ziekte bij deze patiënten tot ontwikkeling op jongere leeftijd.
Veranderingen in de “zuiverheid” van de CAG-herhalingsreeks - d.w.z. aan- of afwezigheid van deze onderbrekingen - kunnen een proces beïnvloeden dat somatische instabiliteit wordt genoemd en waarover we schreven in https://nl.hdbuzz.net/291
De gebruikte EnrollHD-database bij deze observaties bestond uit gegevens afkomstig van personen uit Europa en Noord-Amerika, niet uit andere delen van de wereld. Het Monckton-lab besloot dit anders aan te pakken door samen te werken met een groep uit Zuid-Afrika.
Bij deze Zuid-Afrikaanse populatie zag het Monckton-lab een zeer vergelijkbare verdeling van de verschillende soorten CAG-combinaties, met of zonder deze onderbrekingen. Er waren echter enkele verschillen in een ander deel van het huntington-gen…
Naast de CAG’s bevat het huntingtine-eiwit ook CCG-combinaties, die een eiwitbouwsteen vormen die proline wordt genoemd. Het Monckton-lab bepaalde het aantal prolines bij ZvH-patiënten uit Zuid-Afrika en stelde een verschil met het eiwit van Europese ZvH-patiënten.
Ze gebruikten deze gegevens om te kijken hoe het aantal proline-herhalingen en de letters waaruit die proline-herhalingen bestaan, de aanvangsleeftijd beïnvloeden.
Bij mensen met de ZvH met prolines met een iets andere spelling, begonnen de ZvH-symptomen 10 jaar vroeger. Het opvolgen van de manier waarop deze eiwitbouwstenen worden gespeld, kan de diagnose verbeteren / of helpen voorspellen op welke leeftijd de ziekte begint.
Over het algemeen betekent dit dat andere genetische veranderingen (dan het aantal CAG’s) in het recept van huntingtine, de ziekte kunnen beïnvloeden. De genetica van de ZvH blijkt veel lastiger en complexer dan op het eerste zicht lijkt. Het begrijpen van deze variaties, die leiden tot eerder of later optreden van symptomen, kan onderzoekers helpen nieuwe manieren te vinden om medicijnen te maken voor mensen met de ZvH – en dat is hoopgevend.
De onderzoekers concluderen dat deze veranderingen in het huntingtine-recept geen invloed hebben op de somatische instabiliteit, maar misschien wel op de boodschap van het huntingtine-recept. De structuur van het mRNA-bericht wordt mogelijk veranderd. Interessant is dat geen van de veranderingen die we zojuist hebben beschreven het huntingtine-eiwit zelf verandert. Ze veranderen alleen de spelling van het “recept”. Dit suggereert dat het niet de eiwitgerelateerde veranderingen zijn die de ziekte beïnvloeden, maar eerder veranderingen op RNA-niveau. De veranderende spelling van het RNA kan de manier wijzigen waarop het molecuul wordt gevouwen. Niemand weet wat die vouw-veranderingen betekenen, maar ze kunnen worden gebruikt om therapieën te ontwikkelen.
Dr. Monckton concludeert dat, hoewel het allemaal zo eenvoudig lijkt - mensen met de ZvH hebben verhoogde CAG-herhalingen - het eigenlijk heel ingewikkeld is! Maar onderzoek als dit leert hoe we van deze complexiteit kunnen profiteren om nieuwe medicijnen te ontwikkelen.
Onderzoeken hoe de ZvH individuele cellen in de hersenen beïnvloedt
De volgende spreker is Steve McCarroll, die verbonden is aan de Harvard Medical School en het Broad Institute. Steve zal ons vertellen over zijn onderzoek naar het begrijpen van de ZvH op het niveau van afzonderlijke cellen in de hersenen.
De hersenen bestaan uit veel verschillende celtypes die specifieke functies vervullen. Dr. McCarroll benadrukt de noodzaak inzicht te krijgen in hoe deze vele verschillende celsoorten worden beïnvloed door de ZvH. Zijn laboratorium gebruikt gespecialiseerde technieken om deze soorten te scheiden en hun genetica te begrijpen. Ze zetten zich in om de methodologie op grote schaal te delen wat de hele ZvH-onderzoeksgemeenschap ten goede zal komen.
Dr. McCarroll ontwikkelde een manier om zijn analyses te versnellen - hij groepeert hersenmonsters van verschillende ZvH-patiënten en scheidt de gegevens daarna. Het sneller verkrijgen van gegevens is een groot voordeel, het stelt onderzoekers in staat zo snel mogelijk antwoorden te krijgen.
Dit soort grootschalige analyses worden mogelijk gemaakt door hersendonaties van ZvH-patiënten na hun overlijden. Hersendonaties zijn een belangrijke manier om antwoorden te krijgen over de ZvH in het enige organisme dat ons echt aanbelangt, nl. mensen.
Het McCarroll-lab past deze technieken toe om te begrijpen hoe het aandeel van verschillende soorten cellen in de hersenen verandert naarmate de ZvH-symptomen vorderen. Zijn laboratorium heeft deze veranderingen beschreven naarmate de ziekte evolueert. Dit helpt ons de cellulaire samenstelling van de hersenen bij mensen met de ZvH te begrijpen.
Bij de meeste mensen met de ziekte is er een aanzienlijk verlies aan cellen die medium spiny neurons worden genoemd. Dit is al langer bekend, maar dr. McCarroll heeft ook aangetoond dat er cellulaire veranderingen zijn in veel andere celtypen in de hersenen.
Het verlies aan cellen gaat gepaard met veranderingen waarbij genen worden aan- en uitgezet. Dr. McCarroll heeft in elk celtype de veranderende genen in kaart gebracht naarmate de ziekte vorderde - wauw!
Dit soort gegevens kan binnen specifieke cellen genen identificeren die de ziekte wijzigen. Eén van die aan de ziekte gerelateerde modificaties houdt verband met verlenging van de CAG-herhalingen tijdens het ouder worden van de patiënt.
Bij bepaalde mensen met de ZvH ziet men in de loop van de tijd een toename van het aantal CAG-herhalingen, vooral in de hersenen. Deze toename kan de leeftijd vervroegen waarop de ziekte optreedt. Als men begrijpt wat de oorzaak is van deze toename, kan dit helpen bij het ontwikkelen van medicijnen om het begin van de ziekte te vertragen.
Andere genen, men noemt ze genetische modificatoren, beïnvloeden of en hoeveel de CAG’s in de loop van de tijd toenemen bij een persoon. Het lab van McCarroll heeft bij veel mensen naar deze modificatoren gekeken in individuele cellen!
Weten hoe deze processen op zo'n microniveau verlopen, levert massa’s gegevens op over CAG-expansie in verschillende celtypen en hoe dat de ziektevoortgang beïnvloedt. Interessant is dat hij ontdekte dat CAG-toename in veel grotere mate plaatsvindt in medium spiny neurons, een van de door de ZvH meest aangetaste celtypes. Dit zou kunnen verklaren waarom dit specifieke celtype zo kwetsbaar is bij de ZvH.
Hij heeft deze veranderingen ook vastgesteld in andere celtypen en delen van de hersenen. Afhankelijk van waar in de hersenen een bepaald celtype zich bevindt, kan dit ook de CAG-expansie in dat celtype beïnvloeden. Het is dus niet alleen de cel-identiteit, maar ook de cel-locatie die ertoe doet!
Begrijpen waarom zowel het celtype als de “omgeving” de CAG-expansie in de hersenen beïnvloedt, wordt een belangrijke volgende stap in het ontwikkelen van therapieën om de ziekte te bestrijden.
Deze gegevens van het McCarroll-lab zijn vers van de pers en weerspiegelen recente doorbraken in laboratorium- en analysetechnieken. Ze zijn van plan deze technieken toe te passen op meer humane monsters in verschillende stadia van de ZvH.
ZvH-muismodellen
De volgende spreker is Dr. William Yang van de Universiteit van Californië, Los Angeles, die ons zal spreken over zijn nieuw muismodel, dat in zijn laboratorium onlangs werd ontwikkeld. Recent schreven we over dit nieuwe model in https://en.hdbuzz.net/318
Geen enkel ZvH-muismodel is perfect voor het bestuderen van de ZvH, maar verschillende types kunnen verschillende aspecten van de ziekte vastleggen en verschillende soorten experimenten mogelijk maken. Het Yang-lab is al jaren gespecialiseerd in het maken van muismodellen om specifieke vragen over de ZvH te beantwoorden.
Het kiezen van het juiste model voor specifieke experimenten is van cruciaal belang, aangezien sommige muismodellen alleen bepaalde kenmerken van de ZvH hebben - zoals veranderde genexpressie of eiwitklontering.
De belangrijkste innovatie in het nieuwe muismodel van het Yang-lab is dat het somatische instabiliteit vertoont: het aantal CAG-herhalingen in bepaalde cellen neemt toe in de loop van de tijd. Hierdoor kunnen onderzoekers de gevolgen van de verlenging voor de gezondheid en het gedrag van de muizen begrijpen.
Bij deze muizen geldt dat hoe meer de CAG-herhalingen zich uitbreiden, hoe meer het gedrag en de gezondheid van de hersencellen wordt beïnvloed. Dit bevestigt voor het eerst bij dieren wat we vermoedden op basis van gegevens van menselijk bloed, ruggenmergvocht en hersendonaties.
Het laboratorium gebruikt nu hun nieuw muismodel om beter te begrijpen hoe onstabiele, uitdijende CAG-herhalingen het huntingtine-recept en -eiwit beïnvloeden en hoe schade ontstaat in de cellen.
Dr. Yang deelde ook gegevens van een ander type ZvH-muismodel, waardoor ze kunnen bestuderen hoe genen tijdens her ziekteverloop worden aan- en uitgeschakeld. Het is geweldig dat deze vraag vanuit meerdere invalshoeken wordt benaderd (samen met het McCarroll-lab en anderen).
We nemen nu een korte pauze, maar komen gauw terug met updates van de rest van de sprekers van deze voormiddag. Kom terug voor meer info.
Het huntingtinebericht verwerken
Onze volgende spreker is Dr. Gillian Bates van het Queen Square Institute of Neurology, University College London. Dr. Bates zal ons informeren over hoe het huntingtine-gen wordt verwerkt en hoe we deze informatie misschien kunnen gebruiken om therapieën te ontwikkelen.
Het huntingtine-gen wordt “gesplitst” om kleine stukjes genetische informatie te verwijderen dat zich bevindt tussen de coderende delen. Het gen wordt dan weer in elkaar gezet voordat het eiwit wordt gevormd. Dit proces wordt meestal gebruikt om cellen diversiteit te geven in de informatie die ze kunnen creëren uit een enkel gen.
Maar dit kan fout gaan. Bij de ZvH wordt het huntingtine-gen gebruikt om een heel klein onderdeel van het eiwit te maken, het zogenaamde “exon 1”. Dit exon 1 bevat de CAG-herhalingen en is zeer giftig voor cellen.
Dr. Bates keek naar de hoeveelheden exon 1 in ZvH-muismodellen en in verschillende hersengebieden van mensen met de ZvH. Ze ontdekte dat met langere CAG-herhalingen het splitsingsproces vaker plaatsvond waardoor het exon1-eiwit vaker werd gemaakt,.
Het Bates-lab experimenteert met manieren om verschillende vormen en stukjes van het door splitsing gecreëerde huntingtine-eiwit te detecteren en te onderscheiden. Dit doen ze met verschillende combinaties van antilichamen, een manier om verschillende delen van het eiwit op te sporen.
Dit werk suggereert dat het exon 1-fragment de plaats is waar eiwitaggregatie (klontering) ontstaat. Als we begrijpen hoe dit proces plaatsvindt, kunnen we veel aanwijzingen krijgen over hoe we deze eiwitklonten kunnen verminderen.
Het Bates-lab is gespecialiseerd in innovatieve manieren om verschillende vormen van het eiwit onder een microscoop of in een test te onderzoeken, zoals het maken van nieuwe muismodellen en het behandelen van weefsel met verschillende chemicaliën.
Ze maakten een speciaal muismodel waarbij het splitsingspatroon veranderd werd zodat het exon1-fragment van het huntingtine-eiwit niet meer zou aangemaakt worden.
Bij deze muizen heeft het laboratorium de niveaus toxische eiwitklonten vergeleken met deze van reguliere ZvH-muismodellen. In het nieuwe muismodel was veel minder klontering, wat suggereert dat het exon1-fragment belangrijk is voor het aanmaken van de klonten.
Bij volgende stappen wordt onderzocht hoe verschillen in de klontering van huntingtine het gedrag van muizen en het communicatiepatroon tussen hersencellen kan veranderen.
Soms verschijnen er huntingtine-klonten nabij de celkern - het deel van de cel dat genetisch materiaal herbergt. Het Bates-lab gebruikte meerdere modellen om aan te tonen dat dit alleen gebeurt met humaan huntingtine, niet met muizen-huntingtine.
Deze gegevens suggereren dat er iets unieks is aan menselijk huntingtine dat leidt tot deze ziekmakende eiwitklontering. Dit kan een aanwijzing zijn waarom mensen de enige soort zijn die van nature de ZvH ontwikkelen!
Als we begrijpen welke vormen van huntingtine het meest giftig zijn en waarom, kunnen we medicijnen ontwikkelen om de negatieve effecten ervan in (humane!) hersencellen te bestrijden.
Hoe de cel omgaat met het huntingtine-eiwit
De volgende is Dr. Judith Frydman van de Stanford University. Ze zal het hebben over waarom CAG-aangroei kan leiden tot problemen met “afvalmarkering- en verwijderingssystemen ” in hersencellen.
Hoewel we de oorzaak van de ZvH kennen, is de “normale” functie van het huntingtine-eiwit niet echt bekend. Wat we wel weten is dat het betrokken is bij een verscheidenheid biologische processen - een beetje als het Zwitsers zakmes van de cel.
Daarom debatteren onderzoekers over de vraag of de ZvH een ziekte is die wordt veroorzaakt door verstoring van andere genen of een verstoring van andere eiwitten. Het werk van Dr. Frydman stelt dat de ZvH, althans gedeeltelijk, het gevolg is van verstoring op eiwitniveau.
Het onderzoek van Dr. Frydman is gericht op het begrijpen hoe het huntingtine-boodschapmolecuul, het mRNA, wordt omgezet in een eiwitmolecuul, via een proces dat translatie wordt genoemd.
Cellulaire stress (zoals virale infectie, verminderde beschikbaarheid van eiwitbouwstenen en veranderingen in hoe de machinerie van de cel werkt) kan de manier waarop translatie plaatsvindt veranderen.
Onderzoekers weten dat in humane cellen of in cellen van diermodellen met de ZvH een verhoogde hoeveelheid cellulaire stress ontstaat. Het laboratorium van Dr. Frydman heeft in modellen aangetoond dat onder deze omstandigheden meer huntingtine-eiwit wordt gemaakt.
Wanneer cellen door translatie huntingtine-eiwit aanmaken, gebruiken ze machines die ribosomen worden genoemd. Frydman en collega’s tonen aan dat wanneer cellen gemuteerd huntingtine maken, de ribosomen botsen en een verkeersopstopping veroorzaken bij het huntingtine bericht.
Toen het Frydman-lab onderzocht welke genen waren gewijzigd in berichten met en berichten zonder verkeersophoping, ontdekten ze dat veel van die genen betrokken waren bij het opruimen van eiwitten in cellen.
Eén eiwit, eIF5A genaamd, is niet voldoende beschikbaar in ZvH-modellen. eIF5A is belangrijk om de ribosomen te helpen de files op te ruimen, dus als er minder van dit eiwit aanwezig is, zullen er meer problemen zijn met het maken van nieuwe eiwitmoleculen en het opruimen van de oude.
Samengevat suggereert het werk van Dr. Frydman dat een hele reeks moleculaire storingen die het gevolg zijn van de ZvH, optreden op het niveau van zowel de RNA-boodschap als van het huntingtine-eiwit. Beiden dragen ze bij aan de kenmerken en symptomen van de ZvH die we zien bij patiënten en in ZvH-diermodellen.
Ziekteverschijnselen veroorzaakt door huntingtine
De tweede sessie wordt begeleid door Dr. Balajee Somaliinga (CHDI) en Dr. Ali Brivanlou (The Rockefeller University) en richt zich voornamelijk op de huntingtine-boodschap en –eiwit, en de rol die ze spelen op gezondheid en ziekte.
Vroege effecten veroorzaakt door huntingtine
De eerste spreker van deze sessie is Sandrine Humbert van INSERM. Ze zal ons spreken over haar onderzoek naar de rol van het huntingtine-eiwit tijdens de ontwikkeling van de hersenen.
Het huntingtine-eiwit heeft veel taken in de cel, o.a. het verplaatsen van verschillende moleculen doorheen de cel. Een van de moleculen die door huntingtine wordt geholpen bij het transport in zenuwcellen is BDNF, dat belangrijk is voor het ondersteunen van de gezondheid van hersencellen.
Zowel de normale als de verlengde vorm van het huntingtine-eiwit worden in de zeer vroege levensfase door cellen gemaakt. Het Humbert-lab denkt dat fouten in de verlengde vorm van het eiwit bij mensen met de ZvH verantwoordelijk kunnen zijn voor de symptomen die ze later in het leven ontwikkelen.
Het Humbert-lab heeft ontdekt dat huntingtine belangrijk is voor allerhande functies tijdens de zenuwcel-ontwikkeling. het speelt een rol in hoe zenuwcellen oorspronkelijk worden gevormd, hoe hun uiteindelijke structuur tot stand komt, en ook hoe ze functioneren en verbinding maken met andere zenuwcellen.
In ZvH-muismodellen van Humbert-lab gebeurt deze ontwikkeling niet goed, en dat kan de neurodegeneratie verklaren die later in het leven van deze muizen wordt waargenomen. We schreven eerder hierover, zie https://nl.hdbuzz.net/290
Dr. Humbert veronderstelt dat de verandering in de manier waarop de cellen in ZvH-hersenen verbinding maken, ervoor zorgt dat ze later in het leven kwetsbaar zijn wanneer ZvH-patiënten typische symptomen ontwikkelen.
Haar meest recente werk onderzoekt de rol van huntingtine op de gezondheid en op de ziekte zelf, inclusief hoe het de groei, structuur en beweging van zenuwcellen beïnvloedt.
Het creëren van meer stabiliteit binnen de structuur van de neuronen, vergelijkbaar met ondersteunende steigers voor een gebouw, lijkt later positieve effecten te hebben op hun gezondheid.
Samenvattend lijkt het erop dat, hoewel de ontwikkeling van zenuwcellen anders verloopt in ZvH-modellen, deze cellen zeer veerkrachtig zijn en het tientallen jaren kan duren voordat symptomen zich voordoen.
Huntingtine in andere soorten
Aan de beurt is nu Dr. Raffaele Iennaco van de Universiteit van Milaan & Istituto Nazionale di Genetica Molecolare. Zijn werk gebruikt stamcellen om te begrijpen hoe de structuur van het huntingtine exon1-fragment de celfunctie beïnvloedt.
Dr. Iennaco werkt samen met het laboratorium van Dr. Elena Cattaneo. Hij richt zich op het gebruik van speciale stamcelvormen die bekend staan als “geïnduceerde pluripotente stamcellen” of iPSC’s. Deze cellen van ZvH-patiënten stellen het team in staat om het allereerste begin van het Huntingtine-eiwit te bestuderen.
Dit kleine stukje is slechts een heel klein deeltje van het Huntingtine-eiwit - ongeveer 3% van het volledige eiwit. Maar dit kleine deeltje speelt een zeer grote rol in wat Huntingtine doet in de cel - vooral hoe het zich door de cel beweegt.
Om dit kleine stukje Huntingtine-eiwit beter te begrijpen, heeft het Iennaco-team de exacte sequentie van deze regio bepaald bij 209 verschillende diersoorten! Dit verhoogt ingrijpend het aantal soorten waar we deze informatie over hebben.
Het aantal CAG’s tussen soorten varieert nogal - bij vissen lijkt het altijd 4 CAG’s te zijn, bij hagedissen 5, terwijl mensen zonder de ZvH 17-20 CAG-herhalingen hebben. Waarom verschillende soorten verschillende hoeveelheden CAG’s nodig hebben, is een groot raadsel dat Iennaco graag wil begrijpen.
Ander bewijs uit het werk van Iennaco suggereert dat het huntington-gen moeilijk mutaties accepteert - er zijn veel minder veranderingen in de genetische code van huntingtine dan dat men bij toeval zou verwachen. Dit benadrukt het belang van het huntingtine-gen.
Zijdeaapjes hebben eigenlijk twee Huntingtine-genen! Dit is niet het geval bij andere bestudeerde soorten, maar het toont de belang van het kijken naar meer dan 200 soorten om voorbeelden van zeldzame genetische gebeurtenissen te vinden en zo het Huntingtine-gen beter te begrijpen.
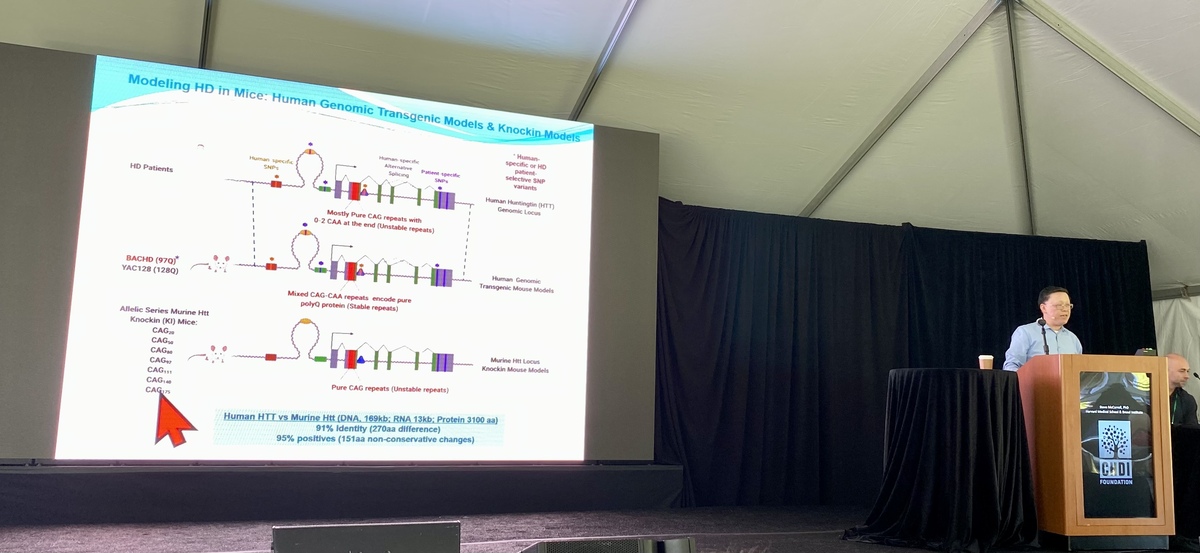
Met behulp van in het laboratorium gekweekte stamcellen kon het team het exacte verband bestuderen tussen de lengte van het CAG-herhalingsgebied en het vermogen van die cellen om zich te ontwikkelen tot de hersencellen die men neuronen noemt. Deze experimenten helpen ons het belang te begrijpen van alle genetische diversiteit die is geïdentificeerd in sequencing-onderzoeken van Iennaco.
Vervolgens concentreerden Iennaco en het team zich op het vergelijken van het huntingtine van muizen met dat van mensen. Hoewel ze erg op elkaar lijken, vonden ze dat het humane Huntingtine-gen giftiger is dan de muisversie. We weten echter niet waarom.
Het team is in staat om met stamcellen die in schaaltjes werden gekweekt, de allereerste fasen van hersenontwikkeling te doorlopen. Dit stelt hen in staat om het belang van kleine veranderingen (in CAG-lengte of tussen soorten) te bestuderen en hun impact op de hersenontwikkeling te meten.
Met behulp van een geautomatiseerd laboratoriumsysteem nam het team beelden van ongeveer 5.000 verschillende mini-hersenen om de impact van kleine veranderingen in de Huntingtine-sequentie beter te begrijpen.
Ze hebben vastgesteld dat veel aspecten van de groei van nieuwe hersencellen meer werd beïnvloed in humaan huntingtine dan in huntingtine van muizen. Dit suggereert dat bij de humane sequentie iets speciaals optreedt dat giftig kan zijn voor nieuwgevormde hersencellen.
Het team heeft zich verdiept in een zeer specifiek deel van het Huntingtine-gen. Ze hopen daar de verklaring te vinden waarom het ZvH-gen giftiger is bij mensen dan bij muizen. Dit ondersteunt het belang van dergelijke genetische studies bij dieren.
Effecten van huntingtine in astrocyten
Wat volgt is een lezing van Prof. Baljit Khakh, van UCLA. Zijn lab is geïnteresseerd in een specifiek type ondersteunende cellen die astrocyten worden genoemd. Astrocyten zijn niet de meest kwetsbare cellen in de ZvH - dat zijn neuronen. Hun taak is om neuronen te ondersteunen.
Astrocyten brengen het ZvH-gen tot expressie. Ze sterven niet vroeg af tijdens de progressie van de ziekte. Ze vertonen wel een aantal veranderingen in vorm en functie wanneer ze een gemuteerde kopie van het ZvH-gen tot expressie brengen. Het laboratorium van Khakh wil weten of deze veranderingen invloed hebben bij de ZvH.
Het laboratorium van Khakh doorzocht enorme datasets met gegevens van de hersenen van ZvH-patiënten en diermodellen, en ze vonden welke genen aan stonden en welke uit. Ze zochten naar aanwijzingen dat astrocyten mogelijk slecht werkten. Dit leek het geval te zijn.
Er werden veranderingen vastgesteld in astrocyten van de hersenen van ZvH-patiënten, maar de vraag is of dit van belang is voor de progressie van de ziekte, of dat dit alleen veranderingen in andere celtypes weergeeft?
Een zeer nuttig hulpmiddel voor het verlagen van de Huntingtine, een zogenaamde “zinkvinger”, kan de expressie van het gemuteerde Huntingtine-gen stoppen. We hebben eerder hierover geschreven bij Buzz, u kan er over lezen https://nl.hdbuzz.net/275
Het UCLA-team was in staat virussen te ontwikkelen die deze Huntingtine-verlagende ladingen afleveren aan verschillende celtypes in de hersenen, waaronder neuronen of astrocyten. Zodoende kan men het huntingtine-gen van verschillende celtypes verlagen.
Deze nieuwe virussen verlagen de niveaus van het huntingtine-gen (eiwit) alleen in het bedoelde celtype, zodat het team specifiek het verband kan onderzoeken tussen de expressie van huntingtine in bepaalde cellen en de ZvH-achtige symptomen bij muizen.
Door mutant Huntingtine in elk celtype inactief te maken, kon men veel van die veranderingen vermijden in dat celtype. Toen gemuteerd huntingtine werd uitgeschakeld in neuronen (het zieke celtype in de ZvH), zagen ze verbeteringen in de astrocyten - de ondersteunende cellen!
Dit is raar! Het suggereert dat er een soort feedbacklus plaatsvindt in het huntington-brein tussen zieke steuncellen en zieke neuronen. Het toont ook de kracht van het manipuleren van specifieke celtypen - dingen zijn niet altijd zoals we denken.
Het team stelde toen de vraag: wat gebeurt er met de ZvH-achtige symptomen bij ZvH-muizen als Huntingtine wordt verlaagd in astrocyten of neuronen met behulp van een ZFP?
Veel van de onderzochte symptomen herstelden door het gemuteerde huntingtine-gen in neuronen te verlagen, echter minder uitgesproken dan bij een verlaging in de astrocyten.
Dit is belangrijk - Khakh houdt van astrocyten en wilde weten of ze ZvH-symptomen veroorzaken. Ze deden een doordachte reeks experimenten en de resultaten toonden aan dat astrocyten veranderen, maar dat veranderingen in neuronen de belangrijkste factor blijven.
Het huntingtin-bericht verwerken
De volgende spreker is Jose Lucas van het Centrum voor Moleculaire Biologie Severo Ochoa (CBMSO). Hij spreekt over hoe de huntingtine-boodschap wordt verwerkt en hoe dit anders verloopt bij mensen met de ZvH.
Het proces waarmee genberichten worden verwerkt, wordt splicing (splitsing) genoemd. Dit onderwerp kwam ter sprake in een paar eerdere sessies waarin ook naar dit proces werd gekeken. Men denkt dat splicing (splitsing) het giftige exon1-fragment van huntingtine creëert.
Splicing gaat mis bij verschillende andere ziektes, dus het begrijpen van de overeenkomsten in dit proces tussen de ziektes kan helpen bij het beantwoorden van vragen over de ZvH en haar symptomen, zoals verlies aan zenuwcellen. Lucas en collega’s hebben onderzocht welke genen worden beïnvloed door veranderingen in het splictsngsproces bij de ZvH. Als de boodschap van een gen verkeerd wordt gesplitst betekent dit vaak dat van die boodschap minder volledig eiwitproduct wordt gemaakt.
Wetenschappers in het Lucas-lab toonden aan dat als ze een gen genaamd RBFOX1 kunstmatig zouden inschakelen, ze de symptomen in een ZvH-muismodel konden verbeteren door de splitsingsfouten te helpen corrigeren. Misschien kan dit idee worden gebruikt om nieuwe medicijnen te maken voor de behandeling van de ZvH?
Genberichten worden ook verwerkt om een “staart” uit hun genetische codereeks te verwijderen. Deze bestaat uit zich steeds herhalende letters A. Het blijkt dat in ZvH-modellen de staart langer is dan nodig, wat van invloed is op hoe deze berichten worden omgezet in hun eiwitproducten.
Een van de meest aangetaste eiwitten die in dit onderzoek werden ontdekt, bracht de wetenschappers tot het besluit dat mensen met de ZvH minder van een vitamine genaamd thiamine hebben. Ze bevestigden dit door de thiaminespiegels in het ruggenmergvocht te meten, wat verminderde niveaus aantoonde.
De wetenschappers zoeken nu antwoorden door klinisch onderzoek op twee verschillende vragen: kunnen thiaminespiegels worden gebruikt als biomarker voor progressie van de ZvH? En kan een behandeling met thiamine de symptomen bij mensen met de ZvH verbeteren?
Hoewel dit algemeen verkrijgbare vitamines zijn waar de Lucas-groep naar kijkt, zijn streng gecontroleerde klinische onderzoeken vereist voor afdoende antwoorden. Hopelijk hebben we binnenkort updates over hoe deze mogelijke behandeling zou kunnen werken bij mensen met de ZvH.
De afbraak van huntingtine-eiwit controleren
Dr. Michael Rapé van het Howard Hughes Medical Institute, University of California, Berkeley, zal de gesprekken voor vandaag afronden. Hij zal zijn werk bespreken over hoe huntingtine in de cel wordt afgebroken en hoe het kan worden gebruikt om de ZvH te behandelen.
Het Rapé-lab is op zoek naar kleine moleculen die het huntingtine-eiwit als doelwit hebben, zodat de machinerie van de cel dit afbreekt en verwijdert, een proces dat bekend staat als eiwitafbraak.
In de cel zijn er bepaalde eiwitten die andere eiwitten markeren voor afbraak. Dus als je dit proces kunt beheersen, kan je bepalen welke eiwitten in de cel worden afgebroken. Dit zou geweldig zijn voor een ziekte als de ZvH waarbij we een schadelijk eiwit willen verminderen of verwijderen!
Een uitdaging voor therapieën voor hersenziekten is om voorbij de bloed-hersenbarrière te komen - de selectieve barrière die de hersenen beschermt tegen schadelijke stoffen in het bloed. De medicijnen die het Rapé-lab ontwikkelt, zijn klein in vergelijking met ASO’s (zoals die werden ontwikkeld door Roche en Wave), maar zijn nog steeds groot in vergelijking met veel andere medicijnmoleculen.
Gelukkig hebben wetenschappers aangetoond dat kleine verdelgers/afbrekers van moleculen via de bloedbaan de hersenen kunnen bereiken, en dat is geweldig nieuws voor onderzoekers die deze stoffen willen maken om ziekten zoals Huntington te behandelen.
Onze cellen maken veel verschillende eiwitten aan die worden gebruikt om “afval” in de cel te “labelen” als geschikt voor afbraak. We noemen ze E3- ligasen. Als we een E3 zouden kunnen vinden die het huntingtine-eiwit labelt, zouden we ook voor huntingtine een afbraakmolecuul kunnen ontwikkelen.
Het Rapé-lab ontwikkelde een ‘scherm’ waarmee men mogelijk geschikte E3-ligasen kan identificeren. Ze vonden een E3 ligase genaamd RNF126 die alle gewenste kenmerken lijkt te hebben voor de ontwikkeling van een huntingtine-afbraakmolecuul die van RNF126 gebruik maakt.
Vervolgens testten ze of RNF126 specifiek het huntingtine-eiwit kon afbreken. Ze ontdekten dat wanneer de aanwezigheid van RNF126 werd verhoogd, dit leidde tot afbraak van schadelijk huntingtine in cellen!
Maar deze experimenten werden uitgevoerd met slechts een deel van het schadelijke, geëxpandeerde huntingtine. Wat gebeurt er met huntingtine van volledige lengte en een verlengde CAG-reeks? We kregen dezelfde resultaten!
Het is alsof ze een speld vonden in een hooiberg, het perfecte enzym dat zich bindt aan huntingtine om het op natuurlijke wijze af te breken en zo eiwitklontering die ziekte veroorzaakt te voorkomen.
De volgende stappen zijn om RNF126 verder te ontwikkelen en te proberen een verbinding te identificeren die, als een moleculaire lijm, RNF126 zou verplichten om te assisteren bij de afbraak van het huntingtine-eiwit. We wachten met spanning af wat de volgende stappen zijn voor deze opwindende molecule!
Blijf bij ons voor verdere informatie
Dat is het voor vandaag. We zien jullie morgen terug voor updates gericht op innovatieve benaderingen voor nieuwe ZvH-therapieën!


