Huntington’s disease therapeutics conference 2022 – dag 2
Bekijk de onderzoeksupdates van dag 2 van 2022 HD Therapeutics Conference #HDTC2022
Goedemorgen en welkom bij dag 2 van HDBuzz-verslaggeving van de CHDI therapeutische conferentie over de ziekte van Huntington!
Innovatieve benaderingen voor huntingtontherapieën
Dr. Michael Finley (CHDI) en Dr. William Martin (Janssen R&D, LLC) zitten de derde sessie van de onderzoeksgesprekken voor die innovatieve benaderingen voor huntingtontherapieën zullen behandelen.

De eerste uiteenzetting is van Dr. Beverly L Davidson van The Children’s Hospital of Philadelphia & University of Pennsylvania, die haar werk aan het verbeteren van gentherapieën voor de ZvH zal bespreken.
Verbetering van gentherapieën voor de ZvH
Het Davidson-lab werkt aan gentherapieën om genetische ziekten zoals de ZvH te behandelen. Ze richten zich op een deel van het huntingtine-gen en op hoe ze de medicijnen het best in de hersenen kunnen krijgen. Onderzoekers willen ervoor zorgen dat ze dit zo efficiënt mogelijk doen. Zoals we gisteren hebben vernomen, zijn er kleine giftige fragmenten van huntingtine die aan het begin van de code – exon1 staan. De focus van het Davidson-lab ligt op dit deel van het huntingtine-gen dat ze het doelwit willen maken van de therapieën die ze ontwikkelen.
Het Davidson-lab werkt met CRISPR. Dit is een zeer nauwkeurig hulpmiddel dat specifieke letters in de DNA-code kan bewerken. Het laboratorium wil gebruik maken van unieke genetische handtekeningen SNP’s (‘snips’) genaamd, om zich te richten op het verlengde huntingtine-gen. Met behulp van deze benadering identificeren onderzoekers SNP’s die alleen op het mutante huntingtine zitten. Hierdoor kunnen hun potentiële therapieën zich specifiek richten op het schadelijk huntingtine en het ‘normale’ huntingtine gerust laten. In een huntingtonmuismodel toonden ze aan dat hun CRISPR-hulpmiddel het niveau van het huntingtine-eiwit met ongeveer 50% verlaagde, het magische getal waarmee het huntingtine moet verlagen om de symptomen van de ZvH te verbeteren. Dat is alvast wat onderzoekers denken.
Vervolgens richtte het Davidson-lab zich op het verbeteren van de manier waarop deze hulpmiddelen aan de cellen worden bezorgd. Ze willen ervoor zorgen dat die effectief en veilig is. Zij gebruikten een handige genetische truc om het expressie-niveau van het bedoelde gen te regelen. Je kan dit beschouwen als een soort lichtdimmer. We schreven eerder over dit nieuwe hulpmiddel: https://en.hdbuzz.net/311
Deze moleculaire dimmer zou heel doeltreffend kunnen zijn voor het huntingtononderzoek. Hij zou nauwkeurige controle van de huntingtineniveaus mogelijk kunnen maken, komt rechtstreeks op de juiste plaatsen in de hersenen terecht en verlaat het lichaam van de muis snel nadat gestopt werd met de toediening ervan. Het Davidson-lab heeft dit hulpmiddel nu verfijnd voor gebruik in huntingtonmodellen en heeft aangetoond dat ze de huntingtineniveaus kunnen aanpassen. Hoe meer medicijnen ze toedienen, hoe meer de dimmer wordt verlaagd.
In de toekomst zal het lab zich richten op het verbeteren van de manier waarop dit CRISPR-hulpmiddel wordt afgeleverd en op het testen ervan bij andere diersoorten waaronder apen. Ze gaven dit hulpmiddel aan de apen door middel van een ruggenprik en ontdekten dat zelfs zeer lage doses terecht kwamen in verschillende hersengebieden waaronder die die het meest door de ZvH zijn getroffen.
Globaal genomen heeft het Davidson-lab een spannend nieuw hulpmiddel ontwikkeld dat zich alleen richt op de verlengde huntingtine-kopie en dat vele delen van de hersenen kan bereiken. Dit gebeurt zelfs bij lage doses en kan nauwkeurig worden gecontroleerd. We zijn benieuwd waar dit naartoe gaat!
CRISPR gericht op RNA
De volgende spreker is Gene Yeo, van de University of California, San Diego, die ook zal praten over CRISPR-technologie en het testen van genetische behandelingen in verschillende diermodellen van de ZvH. Het Yeo-lab is gericht op het begrijpen van eiwitten die binden aan het genetische boodschap-RNA. Ze proberen zich te richten op deze RNA-bindende eiwitten om therapieën te ontwikkelen .
RNA-bindende proteïnes (RBP’s) kunnen de expressie van andere genen regelen. Het Yeo-lab wil weten waar RBP’s binden en heeft hulpmiddelen ontwikkeld waarmee ze individuele cellen dat kunnen aanleren – wow!
Veel experimenten kijken naar veranderingen in hele weefsels of stalen gemaakt van veel cellen. Door naar individuele cellen te kijken, kunnen onderzoekers inzoomen op subtiele maar potentieel belangrijke veranderingen. Een recente publicatie van het Yeo-lab toonde aan dat ze RBP’s konden gebruiken om bepaalde RNA’s ‘op te eten’. Dit zou geweldig zijn om de ZvH te behandelen!
Recentelijk hebben ze een afname van de huntingtine-boodschap aangetoond door het leveren van RBP’s die specifiek gericht zijn op CAG-herhalingen. Ze kunnen dit in meerdere modellen doen, waaronder menselijke neuronen die zijn gemaakt van stamcellen. Toen de CAG-herhalingen in het huntingtine-bericht werden vernietigd, waren ze in staat om enkele door de ZvH veroorzaakte veranderingen in cellen ongedaan te maken! Een verandering die ze opmerkten, was dat de expressie van genen die verband houden met de gezondheid van de hersencellen weer normaal werd. Maar ze wilden weten wat er gebeurt als ze deze therapie bij muizen gebruiken. Maakt het vernietigen van de CAG-herhalingen met hun schitterend werktuig de huntingtonmuizen beter?
Ja! De muizen deden het beter bij prestatietests, ze hadden minder klonters huntingtine-eiwit en gaven verbeteringen te zien in hun hersenstructuren op een MRI. Ook belangrijk, deze genetische benadering leek geen invloed te hebben op andere genen. Dit gave nieuwe hulpmiddel heeft nog wat bevestiging nodig, maar belooft veel voor vele ziekten, en het meest opwindende, voor de ZvH!
SHIELD HD – ondersteunt de ontwikkeling van klinische en biomerkers!
Onze volgende sprekers zijn Drs. Irina Antonijevic & Peter Bialek van Triplet Therapeutics . Ze zullen de SHIELD HD-studie bespreken, een studie die huntingtonpatiënten in de loop van de tijd volgde om klinische verschillen te vinden en biomerkers te identificeren.
Triplet doet onderzoek naar therapieën om de uitbreiding van CAG-herhalingen in hersencellen in de loop van de tijd tegen te gaan. Dit proces staat bekend als somatische instabiliteit. Dit kan een belangrijke oorzaak zijn van het ontstaan van symptomen bij mensen met de ZvH. Door te kijken naar gegevens van alle genetische informatie van individuen met huntington, identificeerden onderzoekers veranderingen in genen die de somatische instabiliteit controleren en die de leeftijd bepalen waarop huntingtonpatiënten de ziekte ontwikkelen. Eén van die genen heet MSH3. Terwijl Triplet een therapie ontwikkelt die gericht is op MSH3, willen ze ook graag beter begrijpen op welk moment patiënten het beste kunnen worden behandeld en welke patiënten het meeste baat hebben bij een therapie gericht op MSH3.
Om beter te begrijpen hoe de CAG-herhalingen verband houden met de huntingtonsymptomen, moeten we mensen een lange tijd volgen. SHIELD-HD staat bekend als een natuurhistorisch onderzoek – er is geen medicijn bij betrokken – maar het volgt mensen op met het huntington-gen die zeer vroege symptomen hebben.
Triplet volgde de patiënten meer dan 2 jaar en nam verschillende stalen, waaronder bloed en ruggenmergvloeistof. Ze analyseerden ook de hersenen van de patiënten met behulp van MRI-scans. Ze ontdekten dat de omvang van verschillende hersengebieden veranderde in de loop van de 48 weken durende SHIELD-HD-studie, met name de caudate en de ventrikels. Dit is zoals we zouden verwachten wanneer de symptomen toenemen bij mensen met de ZvH.
De studie keek ook naar een andere parameter nl. de totale motorscore, om te zien hoe deze in de loop van de tijd veranderde bij mensen in de studie. Zoals verwacht nam dit in de loop van de tijd ook af en zelfs meer voor patiënten in de latere stadia van de ziekte. Hoewel deze veranderingen konden worden verwacht, biedt de SHIELD-HD-studie onderzoekers een uitgebreide dataset die kan worden gebruikt om betere voorspellingen te doen over het verloop van de ZvH. Dit soort datasets kan helpen bij het sneller vinden van het juiste type klinische proef voor patiënten op basis van waar ze zich tijdens hun ziekte bevinden.
Vervolgens gaf Triplet updates over hun medicijn dat zich richt op het MSH3-gen. Ze deden experimenten bij apen om te zien hoe het verminderen van de MSH3-niveaus hun CAG-herhalingen beïnvloedde. Door MSH3 bij de apen met 50% te verlagen, ontdekten ze dat de somatische expansie werd gestopt! Als dit zich vertaalt naar huntingtonpatiënten, kan dit de leeftijd waarop patiënten symptomen beginnen te vertonen, aanzienlijk vertragen.
Triplet is ook geïnteresseerd in het meten van MSH3-niveaus om de ziekteprogressie van de ZvH op te volgen en te zien hoe goed de behandeling werkt. Maar ze liepen tegen een uitdaging aan, omdat het moeilijk is om dit gen in hersenweefsel te detecteren. Om dit probleem te omzeilen, keek het team van Triplet naar de aanwezigheid van MSH3 in het ruggenmergvocht van deelnemers met huntington in de SHIELD-HD-studie. Ze moesten een zeer gevoelige techniek ontwikkelen. Ze blijven experimenteren met verschillende manieren om stalen te verzamelen van het ruggenmergvocht en de hersenen van apen. En ze testen ook TTX-3360, het medicijn dat ze ontwikkelen.
Ze keken ook naar de niveaus van MSH3 in het ruggenmergvocht van patiënten in verschillende ziektestadia. Ze vonden geen verschil in deze niveaus tussen individuen zonder en mensen met de ZvH die geen symptomen hadden of heel vroeg in hun ziekte waren. Deze bevinding is belangrijk omdat het de onderzoekers van Triplet een uitgangswaarde van MSH3 geeft. Die kunnen ze dan volgen wanneer ze TTX-3360 naar een fase 1-klinische studie brengen. Tevens kunnen ze kijken hoe de niveaus van MSH3 veranderen met de behandeling. Observatie-onderzoeken zoals SHIELD-HD verzamelen niet alleen veel waardevolle gegevens van huntingtonpatiënten in de loop van de tijd, maar ze stellen onderzoekers ook in staat nieuwe potentiële behandelingen te ontwikkelen, zoals die welke vandaag door Triplet worden beschreven. Gaaf!
Tijd voor een pauze! We komen zo terug voor de rest van de presentaties van vanmorgen. Blijf kijken!
Nieuwe biologische inzichten
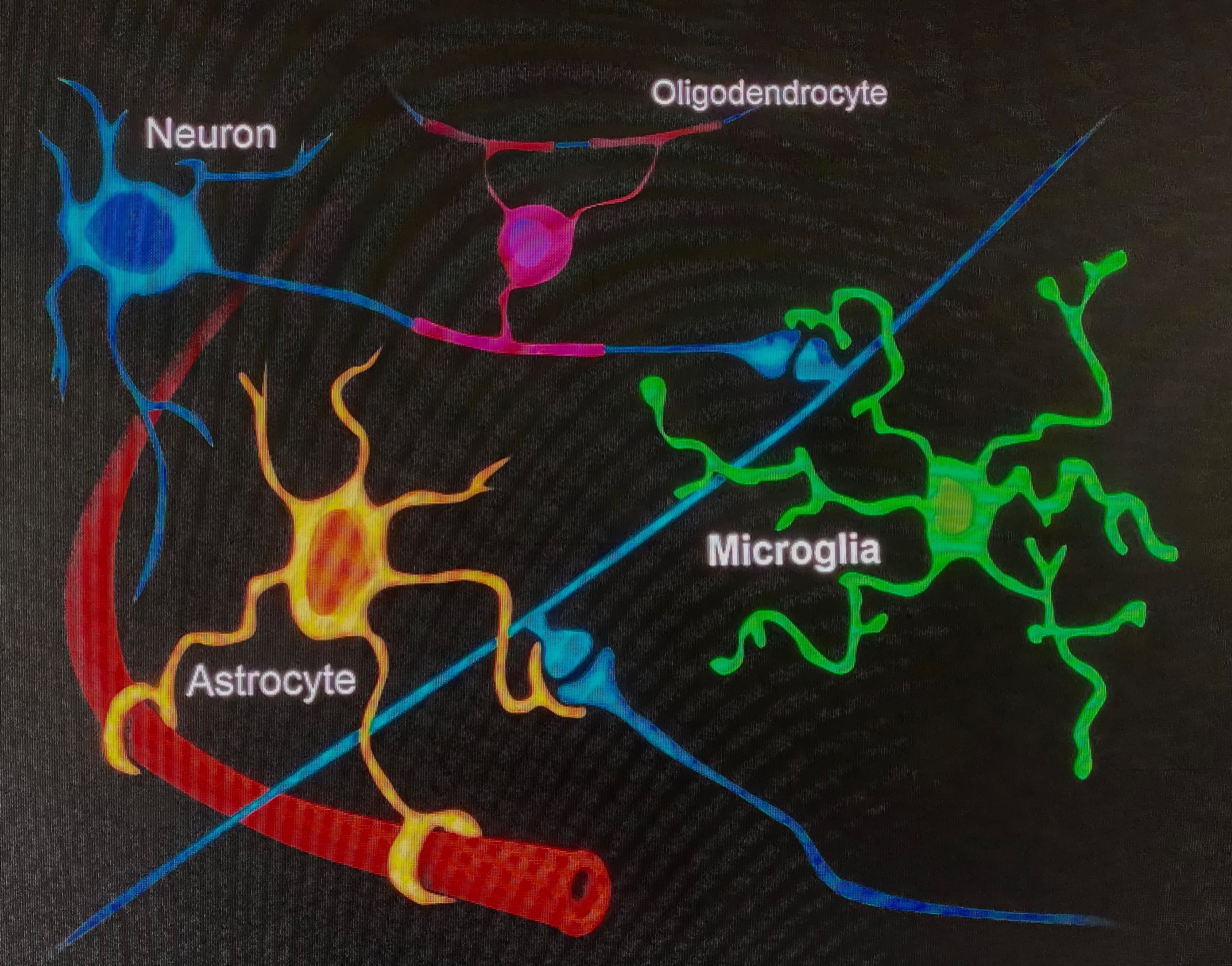
De volgende spreker is Dr. Beth Stevens van het Boston Children’s Hospital en het Broad Institute, die zal praten over haar onderzoek dat inzicht zou kunnen bieden voor de overgang van behandelingen naar de klinische praktijk. Dr. Stevens bestudeert nog een andere gespecialiseerde hersencel, microglia genaamd, die fungeert als het immuunsysteem van de hersenen. Deze cellen beschermen tegen indringers en helpen bij het opruimen van restmateriaal van beschadigde hersencellen.
Microglia zijn klein (vandaar ‘micro’) en beslaan slechts ongeveer 10% van de cellen van de hersenen. Maar wanneer ze schade oplopen of wanneer bacteriën binnendringen, worden ze geactiveerd en gaan ze aan het werk om de rommel op te ruimen. De activering van deze belangrijke helpercellen is normaal gesproken een goede zaak voor de hersenen, maar bij een reeks ziekten – waaronder de ZvH – werd lang gedacht dat ze misschien een beetje overactief waren.
Stevens is een wereldautoriteit op het gebied van de rol van microglia bij gezondheid en ziekte. Zij heeft aangetoond dat een van de rollen van microglia in de hersenen is om synapsen op te eten. Dit zijn de bolvormige verbindingen tussen communicerende hersencellen die neuronen worden genoemd. Synapsen zijn goed, maar moeten verwijderd worden om nieuwe informatie in de hersenen te coderen.

Er is een cel-naar-cel communicatiesysteem, het ‘complementsysteem’ dat microglia beveelt om een bepaalde synaps of cel op te eten of niet. Jaren geleden ontdekte het team van Stevens dat dit complementsysteem door microglia in de hersenen wordt gebruikt om te beslissen welke hersendeeltjes moeten worden opgegeten. Bij veel hersenziekten – waaronder de ZvH – wordt dit complementsysteem overactief en eet het stukjes op die duidelijk zijn gelabeld met een ‘eet mij niet’-signaal. Het team wil begrijpen of het complementsysteem een sleutelrol speelt bij het verlies van synapsen waarvan bekend is dat ze optreden bij de ZvH.
Het team heeft zeer geavanceerde microscooptrucs ontwikkeld om specifieke populaties van synapsen te identificeren in hersengebieden die getroffen zijn door de ZvH. Bij huntingtonmuizen is er een zeer specifiek patroon van synapsverlies dat verergert tijdens het ouder worden. Soortgelijke veranderingen worden gezien in de hersenen van huntingtonpatiënten. Zoals ze bij andere ziekten hadden gezien, waren diezelfde kwetsbare synapsen gelabeld met ‘eet mij’-signalen voor het complementsysteem. Dat suggereert dat microglia in huntingtonmuizen en -patiënten zouden kunnen helpen deze kritieke synapsen uit de hersenen te verwijderen, wat mogelijk bijdraagt aan ziekteprogressie.
In hersenen die door huntingtonpatiënten waren gedoneerd, vond het team van Stevens duidelijk bewijs van ontstoken, geactiveerde microglia . Daarna keerden ze terug naar muizen, waar ze dit systeem kunnen manipuleren om te zien welke rol het speelt bij ziekteprogressie. Een bedrijf – Annexon Biosciences – heeft een medicijn ontwikkeld dat complementactivering blokkeert. Hierdoor kunnen we ons afvragen of het blokkeren van deze hyperactieve “eet me”-activiteit bijdraagt aan de ontwikkeling van huntingtonachtige symptomen bij ZvH-modelmuizen. Het behandelen van huntingtonmuizen met dit medicijn deed wat het moest doen. Het zorgde ervoor dat het ‘eet mij’-label niet op kritieke hersengebieden werd geplaatst. Dit stelt ons in staat om ons af te vragen of deze synapsverwijdering goed of slecht is bij ziekten zoals huntington. Met behulp van een andere benadering – een genetische verandering in de muizen om het complementsysteem volledig te blokkeren – bestudeert het team de relatie tussen complementactivering en symptomen. Ze zien bescherming tegen sommige ZvH-achtige symptomen bij huntingtonmuizen.
Maar hoe zit het met huntingtonpatiënten, gebeuren soortgelijke dingen in de hersenen van echte patiënten? Door gebruikt te maken van Clarity kreeg het team toegang tot hersenvocht van huntingtonpatiënten. Deze vloeistof, die de hersenen omringt, kan een niet-invasieve manier zijn om herseneiwitten te bemonsteren. In overeenstemming met hun voorspellingen waren er duidelijke tekenen van verhoogde activering van het complementsysteem in het ruggenmergvocht van huntingtonpatiënten. Een kleine menselijke studie wordt momenteel uitgevoerd door Annexon.
Heel gaaf om te zien hoe schijnbaar zeer basale biologische onderzoeken snel kunnen worden vertaald naar onderzoeken bij huntingtonpatiënten!
Stamcelonderzoek!
Dr. Leslie Thompson, van UC Irvine, is de volgende spreker. Thompson is al lange tijd een voortrekker op het gebied van het gebruik van stamcellen om de ZvH te begrijpen en te behandelen. Stamcellen zijn heel speciale cellen die kunnen worden geprogrammeerd om een ander celtype in het lichaam te worden, inclusief de hersencellen die kwetsbaar zijn bij de ZvH.
Historisch gezien moesten deze cellen worden geïsoleerd uit menselijke embryo’s, maar recentelijk hebben onderzoekers geleerd om reguliere cellen van volwassen mensen over te halen om stamcellen te worden. Deze ‘geïnduceerde pluripotente stamcellen’ zijn een geweldig hulpmiddel waarmee onderzoekers echte hersencellen in het laboratorium kunnen genereren.
Dr. Thompson vertegenwoordigt een groot consortium – genaamd Stem Cells for HD (SC4HD) – dat de inspanningen coördineert om mogelijke celvervangende behandelingen voor huntington te ontwikkelen. Ze hebben enorme studies uitgevoerd om stamcellijnen te ontwikkelen als een potentiële bron voor transplantatiestudies bij mensen met de ZvH. Cellen zijn ingewikkeld! Het team heeft een enorme hoeveelheid standaardisatie uitgevoerd om een zeer goed omschreven bron van donorcellen te vormen.
Ze gebruiken deze menselijke stamcellijnen in experimenten in huntington-muismodellen om te zien of het transplanteren van cellen in de hersenen de ZvH-achtige symptomen bij muizen verbetert. Opwindend is dat transplantatie van menselijke stamcellen tot significante verbeteringen leidt. Dit is het bewijs dat het implanteren van stamcellen kan leiden tot verbeteringen in de huntington-relevante symptomen bij muizen. Als het team de basis van deze verbeteringen begrijpt, kan het mogelijk voorspellen welke symptomen ze bij huntingtonpatiënten moeten bekijken.
Langdurige muisstudies laten een behoorlijk opvallende verbetering zien in de bewegingssymptomen van een huntington-muismodel dat is behandeld met menselijke stamceltransplantaties. Het is opwindend dat het team hun procedures heeft kunnen verfijnen om de overlevingskansen van getransplanteerde cellen te vergroten.
Thompson schetst de klinische onderzoeken die het consortium doet om te voldoen aan alle vereisten van regelgevers voor testen bij mensen. Een voor de hand liggende bekommernis bij stamcellen is te voorkomen dat ze uitgroeien tot onverwachte celtypen of dat ze tumoren veroorzaken. Deze ondersteunende onderzoeken zijn aan de gang – inclusief het testen van de chirurgische benaderingen die nodig zijn om stamcellen op de juiste plaats in het huntingtonbrein te implanteren. We willen geen transplantaties op de verkeerde plek!
Dit is het einde van een boeiende reeks lezingen gericht op nieuwe behandelingen voor de ZvH. Vanmiddag is er een prominente spreker, David Baker, van de Universiteit van Washington. We zullen die bespreking niet tweeten – dus houd ons in de gaten voor meer spannende updates morgen!
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…