Ziekte van Huntington Therapeutische Conferentie 2019 - dag 3
Nieuwe inzichten in het huntingtine-eiwit en verdere vooruitgang bij het omvormen van genetische eigenaardigheden die het verloop van de ZvH veranderen in behandelingen, op de laatste dag van de therapeutische conferentie
 Geschreven door Joel Stanton en Dr Jeff Carroll 6 maart 2020 Bewerkt door Professor Ed Wild Vertaald door Marit Mentink Origineel gepubliceerd op 2 maart 2019
Geschreven door Joel Stanton en Dr Jeff Carroll 6 maart 2020 Bewerkt door Professor Ed Wild Vertaald door Marit Mentink Origineel gepubliceerd op 2 maart 2019
Jeff en Ed rapporteren over de Ziekte van Huntington Therapeutische Conferentie - de grootste jaarlijkse bijeenkomst van ZvH-onderzoekers. De conferentie van dit jaar is groter en spannender dan ooit.
Lees hier over dag 1.
Lees hier over dag 2.
Donderdagochtend – de structuur en functie van huntingtine
De laatste dag van de ZvH Therapeutische Conferentie begint met een sessie over de biologie van het ZvH-gen zelf. Het is belangrijk om te begrijpen wat dit gen normaal doet en hoe deze functies worden veranderd door de mutatie die de ZvH veroorzaakt. Het ZvH-gen, door wetenschappers ‘huntingtine’ genoemd, wordt niet alleen gevonden bij ZvH-patiënten, maar bij alle mensen op aarde. Waarom hebben we dit gen en wat doet het om onze cellen te helpen overleven?
Als eerste is Rick Myers van Hudson Alpha aan de beurt. Hij beschrijft het werk van zijn laboratorium om te proberen te begrijpen wat het ZvH-gen inschakelt . Genen zitten in ons DNA, waar ze inactief zijn totdat ze verzocht worden door cellulaire machines, die vervolgens aan het werk gaan om specifieke genen te activeren. Het werk van Myers kan ons helpen de basisbiologie van het ZvH-gen te begrijpen, wat belangrijk is, maar mogelijk ook nieuwe hulpmiddelen bieden om de expressie ervan te verlagen. Het ZvH-gen wordt niet alleen in hersencellen aangetroffen, maar in veel (of misschien alle) cellen van het lichaam.
Myers maakt deel uit van een groot consortium van onderzoekers, het ENCODE-project genaamd, dat wil nagaan hoe veranderingen in de structuur van DNA het mogelijk maken bepaalde genen in- of uit te schakelen. U kunt meer lezen over het ENCODE-project op de Wikipedia-pagina.
In de cellen is het DNA chemisch gewijzigd om het plakkerig en meer geconcentreerd te maken, of juist losser en meer open te maken. Het beweegt ook rond - Myers beschrijft DNA-lussen die op zeer lange afstanden samenwerken. Het team van Myers heeft DNA-sequenties geïdentificeerd, meer dan 100.000 DNA-letters verwijderd van het ZvH-gen zelf, die de expressie ervan beheersen. Ze bouwen in feite een kaart van de DNA-omgeving van het ZvH-gen - wat schakelt het in en wat schakelt het uit? Deze enorme lussen van DNA rond het ZvH-gen werken op zeer specifieke manieren samen. Omdat het zo reproduceerbaar is, betekent dit waarschijnlijk dat deze lussen belangrijk zijn voor hoe het ZvH-gen wordt geactiveerd en ingeschakeld.
Vervolgens beschrijft professor Gill Bates van UCL het werk van haar laboratorium om het proces van ‘verbinding’ van het ZvH-gen te begrijpen. De meeste genen - vooral grote zoals het ZvH-gen - zijn neergeschreven in stukjes DNA, afgewisseld met lange stukken DNA die helemaal niet bijdragen aan het eiwit. Het grootste deel van het DNA in het gebied van het ‘ZvH-gen’ maakt dus eigenlijk geen deel uit van het gen. Biologie is raar! Dus als cellen een gen nodig hebben zoals het ZvH-gen, moeten ze elk stuk lezen - zoals de hoofdstukken van een boek - en alle onbelangrijke DNA ertussenin verwijderen. In het ZvH-gen zijn er 67 van deze hoofdstukken. Dit proces waarbij alle hoofdstukken aan elkaar worden genaaid, wordt ‘verbinding’ genoemd.
Het laboratorium van Bates heeft iets heel grappig ontdekt - in mutante ZVH-genen blijft soms een beetje van het DNA tussen hoofdstuk 1 en hoofdstuk 2 over wanneer het gen wordt verbonden. Dit zou niet moeten gebeuren - elk hoofdstuk wordt normaal netjes uitgeknipt en aan zijn buren geplakt. Dit leidt tot het aanmaken van een klein beetje ZvH-eiwit - slechts ongeveer 3% van het hele ZvH-eiwit. Het laboratorium probeert nu te achterhalen of dit kleine ZvH-eiwit problemen kan veroorzaken in de hersenen van mensen met ZvH-mutaties.
Ze kijken nu in hersenstalen die zijn gedoneerd door ZvH-patiënten, waar ze aanwijzingen zien voor veranderde verbindingen van het ZvH-gen, vergelijkbaar met wat ze bij muizen hebben gezien. Maar doen deze veranderingen ertoe? Bates’ laboratorium werkt met twee lijnen van ZvH muizen, die een verschillende ernst van de ziekte hebben, om dit te proberen te begrijpen. Muizen met deze verandering in verbinding zijn zieker, wat klopt met haar hypothese. Het laboratorium kiest nu voor een nog directere benadering. Ze maken muizen zonder dat extra beetje DNA dat per ongeluk in gemuteerde ZvH-genen is geplakt. Deze muizen moeten ons in staat stellen te bepalen of deze veranderingen in verbindingen invloed hebben op de ZvH. Deze muizen missen het grootste deel van het rare mini-ZvH-eiwit, maar zijn verder normaal. We verwachten straks te begrijpen hoeveel het kleine ZvH-eiwit ertoe doet. Het valt nog te bezien wat dit betekent voor menselijke ZvH-patiënten!
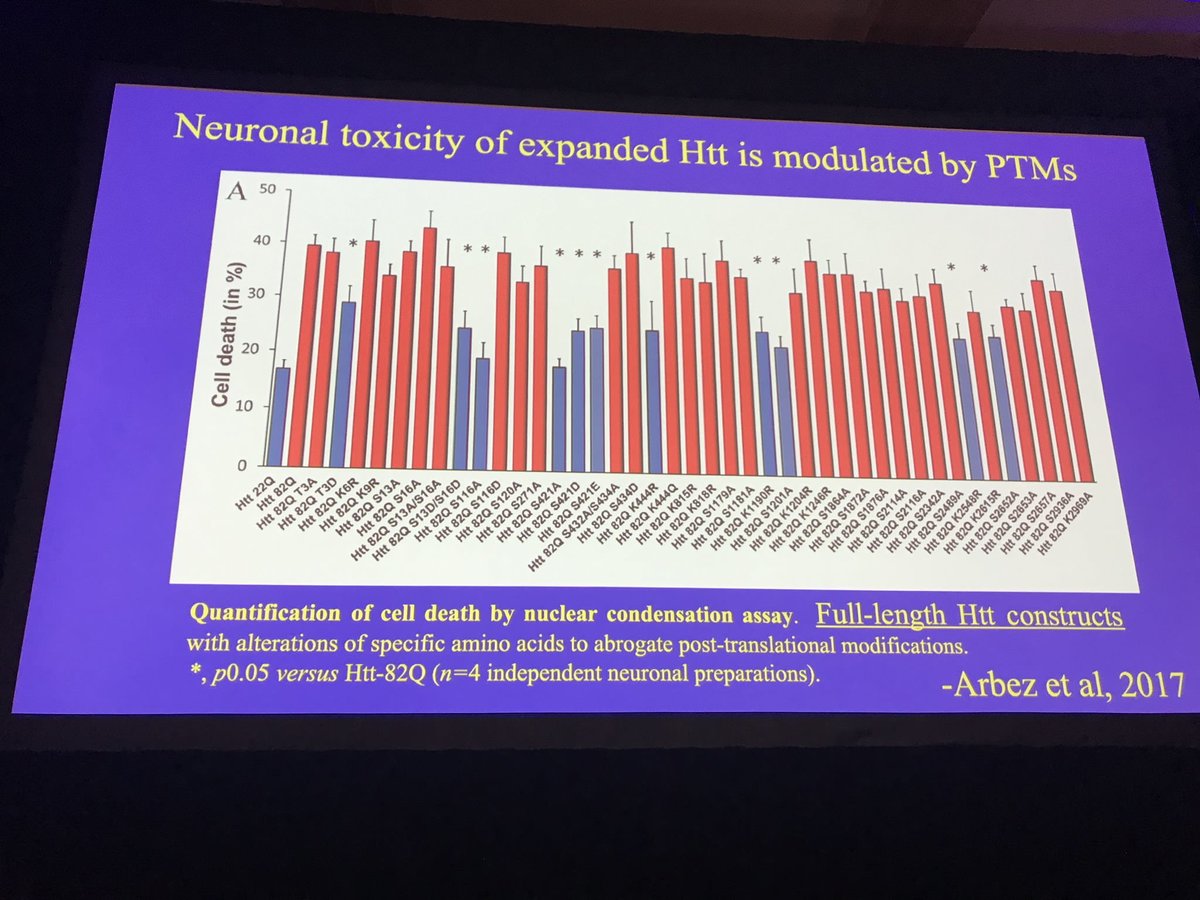
Vervolgens introduceert Chris Ross van Johns Hopkins University het onderwerp ‘post-translationele modificatie’ - dat zijn kleine chemische veranderingen die worden aangebracht in eiwitten om te zien dat het gedrag van dit eiwit verandert. Zoals bijvoorbeeld het schilderen van strepen op een auto de auto sneller laat gaan. Onze beste vriend en vijand, het huntingtine-eiwit, kan op veel verschillende manieren worden aangepast nadat het is gemaakt. We weten waar deze wijzigingen zijn - over de lengte van het eiwit - maar het is minder duidelijk wat ze doen, waarom ze worden toegevoegd of verwijderd, of dat ze het eiwit meer of minder schadelijk maken.
Het team van Ross keek naar tientallen individuele wijzigingen en testte ze in cellen die in een schaal werden gekweekt. Ze onderzochten of door deze modificaties het eiwit meer of juist minder cellen ging doden, en vonden dat sommige wijzigingen de schade van het huntingtine-eiwit verminderden. Sommige van deze wijzigingen, en de machines die ze toevoegen of verwijderen, kunnen goede doelen zijn voor het testen van medicijnen om neuronen te beschermen.

Een grote doorbraak vorig jaar was dat de structuur van huntingtine voor het eerst werd ontdekt - lees hier meer over. Dit laat slimme mensen zoals Ross voor het eerst begrijpen waar precies de wijzigingen die ze hebben bestudeerd daadwerkelijk op het eiwit in de 3D-ruimte zitten. Maar hoe zetten we deze wijzigingen om in behandelingen? De eerste stap is om erachter te komen welke verandering we willen te weeg brengen (om het eiwit minder gevaarlijk te maken). De volgende is om erachter te komen welke enzymmachine de meest interessante wijzigingen aanbrengt of verwijdert.
Een kleine “ooh” kwam uit het publiek bij dit mooie stukje werk om twee grote gebieden van ZvH-onderzoek samen te brengen - huntingtinestructuur en post-translationele modificatie.
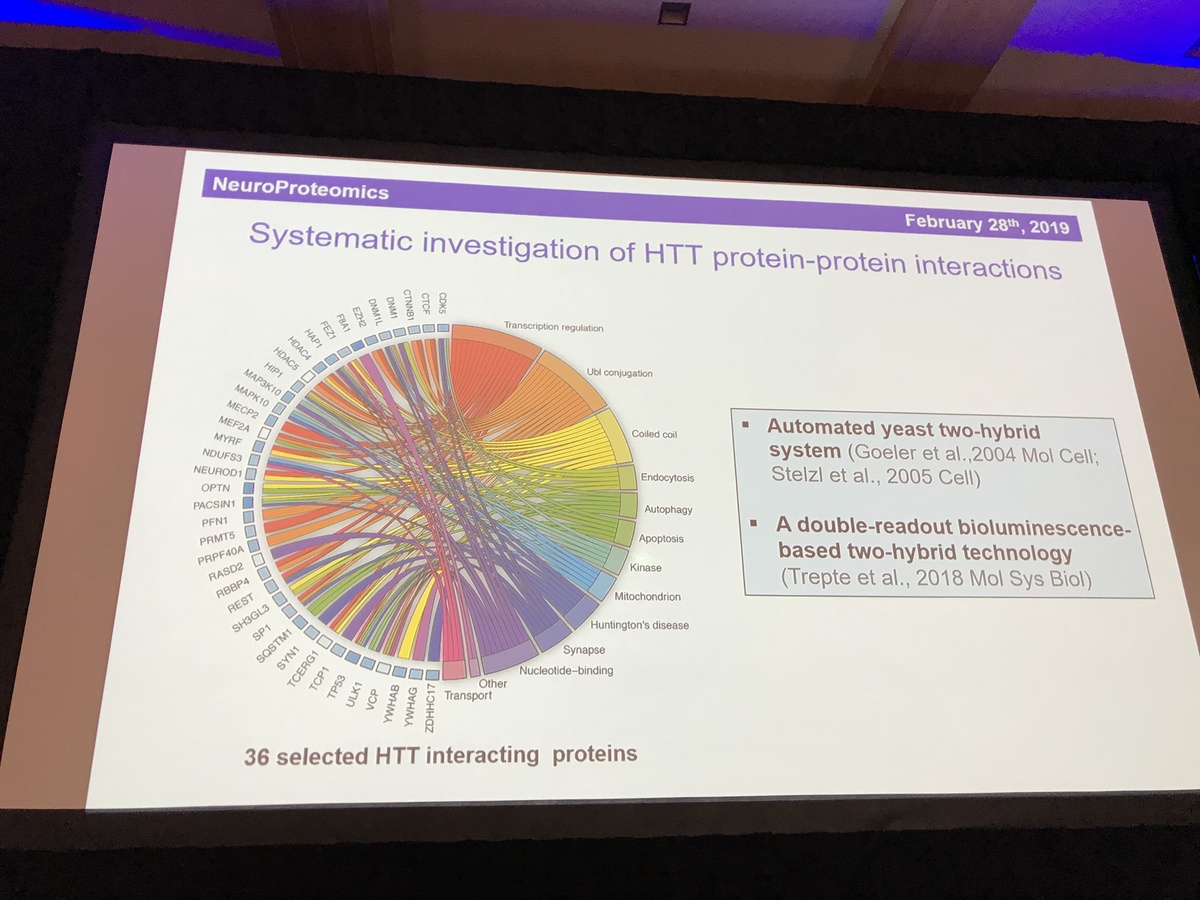
De laatste spreker in deze sessie is Erich Wanker (hij is Oostenrijks, dus de W wordt uitgesproken als een V). Erich is een expert in het gedrag van het huntingtine-eiwit. Hij gebruikt fruitvliegjes om te bestuderen hoe het mutante ZvH-eiwit ervoor zorgt dat cellen doodgaan. Net als Chris Ross heeft het werk van Erich een grote impuls gekregen door de ontdekking van de structuur van huntingtine-eiwit vorig jaar. Een van de belangrijkste dingen van een eiwit zijn zijn vrienden - welke andere eiwitten zijn in de buurt? We noemen dit de “interactiepartners” van een eiwit.
Nadat de lijst van 413 interactiepartners werd teruggebracht tot 36 die er bijzonder interessant of belangrijk uitzien, bekijkt hij nu in de wetenschappelijke literatuur welke gevonden interacties echt zijn en hoe sterk huntingtine aan elk bindt. Om het realistischer te maken, bestudeert hij de interacties in levende cellen. Zijn testsysteem onderzoekt de sterkte en nabijheid van de interacties om ons in staat te stellen een idee te krijgen van welke partners het belangrijkst zijn voor huntingtine. Deze partners wijzen op belangrijke rollen voor huntingtine bij recycling, transport en het verpakken van signaalmoleculen in kleine bellen, blaasjes genoemd. Eén eiwit, HAP1, lijkt bijzonder belangrijk. HAP staat voor huntingtine-geassocieerd eiwit. Een andere belangrijke partner is HAP40 - maar het is nog niet duidelijk waarom. Door de effecten van deze partnerschappen in kaart te brengen, kunnen we huntingtine beter begrijpen in zijn gemuteerde en gezonde vormen.
Donderdagmiddag - DNA-reparatie en -behandeling
De conferentie wordt afgesloten met een spannende sessie gericht op genetische modificatiemiddelen - andere genen dan het ZvH-gen die wij belangrijk vinden voor de ZvH. Er is aangetoond dat variaties in deze genen ervoor zorgen dat mensen eerder of later symptomen van de ZvH krijgen. We hebben dit idee al eerder besproken op HDBuzz - u kunt hier meer lezen.
De eerste spreker vanmiddag is Marcy MacDonald, van Massachusetts General, een belangrijk lid van het team dat het ZvH-gen in 1993 identificeerde. Sindsdien is ze blijven werken aan het begrijpen van de genetica van de ZvH.
MacDonald bespreekt het werk van een groep onderzoekers, het ‘GeM-ZvH’ consortium genaamd. Ze onderzoeken DNA-variaties buiten het ZvH-gen die worden geassocieerd met mensen die eerder of later ZvH-symptomen ervaren. Ze zegt: “De natuur heeft al een succesvolle ZvH-studie uitgevoerd”, wat betekent dat we mensen hebben gevonden die kleine eigenaardigheden in hun DNA hebben geërfd, waardoor ze later symptomen van de ZvH kregen. Dit is echt geweldig nieuws, want we hoeven ons niet af te vragen of het mogelijk is om de ZvH te vertragen - deze mensen bewijzen dat het mogelijk is. Nu moeten we er gewoon achter komen hoe we die genetische effecten opnieuw kunnen creëren met medicijnen die we iedereen kunnen geven.
Deze genetische modificatiestudies beginnen met een grote verzameling ZvH-patiënten, waarvan we de leeftijd kennen waarop bewegingsproblemen van ZvH ontstaan. Hoewel dit grotendeels wordt bepaald door de ‘CAG-lengte ‘die een persoon ervaart van zijn ouder met de ZvH, is er nog steeds veel variatie in de leeftijd waarop de symptomen beginnen. Onderzoekers gebruiken speciale microchips om enorme aantallen DNA-letters te lezen - 11.000.000 daarvan. Dit resulteert in een soort kaart op hoog niveau van de gehele verzameling DNA van elke deelnemer, oftewel ‘genoom’.
Na dit bij 4.000 ZvH-patiënten te hebben gedaan, vond het GeM-ZvH-consortium vier verschillende regio’s van het genoom die werden gevonden bij mensen die vroeg of laat symptomen van de ZvH krijgen. In feite vonden ze variaties die verband hielden met zowel het versnellen als vertragen van de ZvH. Dus bij mensen die een van deze variaties erven, kon voorspeld worden dat ze eerder of later symptomen van de ZvH zouden ervaren dan mensen die dat niet deden. Dit is niet alleen belangrijk voor hen, het is voor iedereen nuttig omdat de identificatie van die genen ons veel kan leren over de ZvH. Heel interessant is dat verschillende van deze genen belangrijk zijn om cellen te helpen een proces uit te voeren dat DNA-reparatie wordt genoemd. Dit suggereert dat verstoringen in DNA-reparatie de ontwikkeling van de ZvH zouden kunnen stimuleren.
Nu beschrijft MacDonald de resultaten van hun nieuwe studie, met meer dan 9.000 proefpersonen! Dit onthult verschillende andere nieuwe genen die het begin van de ZvH beïnvloeden, waaronder meer DNA-reparatiegenen. Interessant is dat zeldzame variaties in het ZvH-gen zelf ook het begin van de ziekte bleek te wijzigen. We zeggen dit niet vaak, maar dit is te ingewikkeld om op te nemen in deze samenvatting, dus we zullen volgende week een HDBuzz-verhaal publiceren waarin het wordt beschreven.
Het team van MacDonald ontwikkelt ook nieuwe wiskundige technieken om de voortgang van de ZvH beter vast te leggen, waarvan ze weten dat het ingewikkelder is dan een enkele ‘diagnose’. Specifiek hebben ze geprobeerd nauwkeurig te schatten hoe slecht de dagelijkse functie is van mensen tijdens het verloop van de ZvH, in plaats van te kijken naar een enkel punt van ‘begin’ of ‘diagnose’. Ze analyseren alle genetische modificatiestudies opnieuw met behulp van deze nieuwe tools om te zien of ze kunnen leren welke genen belangrijk zijn voor verschillende aspecten van de ZvH-symptomen.
Vervolgens spreekt Peter Holmans, van Cardiff University, die ook lid is van het GeM-ZvH-consortium en interesse heeft om te begrijpen hoe genetische veranderingen bijdragen aan ziekte. Hij spreekt de conferentie toe over een soort genetische score die een ‘polygene risicoscore’ wordt genoemd. Het klinkt ingewikkeld, maar het concept is vrij eenvoudig - het is een manier om zeer kleine genetische risico’s te combineren in één enkele gecombineerde risicoscore. In tegenstelling tot de ZvH worden veel ziekten niet veroorzaakt door een enkele mutatie in één enkel gen, maar worden ze beïnvloed door veel kleine genetische risico’s. Nu we goedkoop en gemakkelijk honderden of duizenden genetische variaties kunnen meten, kunnen we polygene risicoscores eenvoudig berekenen.
Holmans richt zich op de psychiatrische symptomen van de ZvH - symptomen zoals agressie, depressie en probleemgedrag. Ze kiezen voor een interessante benadering van het zoeken naar genetische variaties die deze symptomen beïnvloeden, onafhankelijk van de algemene ontwikkeling van de ZvH. Met behulp van polygene risicoscores van psychiatrische ziekten zoals ernstige depressie, merkt Holmans op dat ZvH-patiënten met deze genetische variaties eerder specifieke symptomen hebben. Na meer werk kan dit ZvH-families in staat stellen een idee te krijgen van welke symptomen ze met name het risico lopen om te ontwikkelen. Aangezien veel van deze - inclusief depressie - te behandelen zijn, zou dat nuttige informatie kunnen zijn voor gezinnen.
Vervolgens beschrijft Hilary Wilkinson van de CHDI-stichting de inspanningen van de stichting om te begrijpen hoe DNA-herstelgenen een rol kunnen spelen bij de ontwikkeling van de ZvH. Naast het ZvH-gen zelf, zijn deze nieuwe genetische aanknopingspunten nu de meest opwindende manieren om de ZvH te beïnvloeden. Dat komt omdat de genetische modificatiestudies bij ZvH-patiënten suggereren dat kleine veranderingen in de volgorde van deze genen het ontstaan van de ZvH aanzienlijk kunnen beïnvloeden. Het hele punt van het doen van genetische testen is om genen te identificeren waarmee we dingen kunnen proberen met behulp van chemicaliën in de hoop de genetische effecten te repliceren.
CHDI financiert en ondersteunt een breed scala aan inspanningen om precies te begrijpen welke DNA-reparatiegenen het ZvH-gen beïnvloeden en of we medicijnen kunnen ontwikkelen om dit bij ZvH-patiënten te proberen. Met behulp van muismodellen kunnen ZvH-onderzoekers precieze genetische bewerkingen uitvoeren die DNA-reparatiegenen uitschakelen om te bestuderen hoe ze het ZvH-gen en ZvH-achtige symptomen bij muizen beïnvloeden. Wilkinson beschrijft een fenomeen dat ‘somatische instabiliteit’ wordt genoemd, wat resulteert in de verlenging van de CAG-herhaalgebieden van het ZvH-gen. Dit gebeurt in sommige, maar niet in alle, cellen van het lichaam, inclusief de meest kwetsbare hersencellen die afsterven bij de ZvH. De meeste genen die in de genoombrede studies zijn ontdekt, spelen een rol in het proces van somatische instabiliteit, wat een enorme belangstelling heeft gewekt voor dit proces in het ZvH-onderzoeksveld.
Wilkinson sloot af met een beschrijving van een zeer breed scala aan experimenten die door CHDI rechtstreeks en met academische partners worden uitgevoerd om te zoeken naar medicijnen die het proces van somatische instabiliteit kunnen beïnvloeden.
Dat was alles voor de Ziekte van Huntington Therapeutische Conferentie van dit jaar! Lees over dag 1 hier en dag 2 hier.