
Ziekte van Huntington Therapeutische Conferentie 2019 – dag 2
Nieuwe tools om de kloof tussen het laboratorium en de patiënten te overbruggen in onze update van dag twee van de ZvH Therapeutische Conferentie 2019

Jeff en Ed rapporteren over de ziekte van Huntington Therapeutische Conferentie – de grootste jaarlijkse bijeenkomst van ZvH-onderzoekers. De conferentie van dit jaar is groter en spannender dan ooit.
Lees hier over dag 1.
Geavanceerde hulpmiddelen voor translationeel onderzoek
Goedemorgen iedereen! De tweede dag van de ZvH Therapeutische Conferentie 2019 begint in Palm Springs. De eerste sessie gaat over ‘geavanceerde hulpmiddelen voor translationeel onderzoek’.
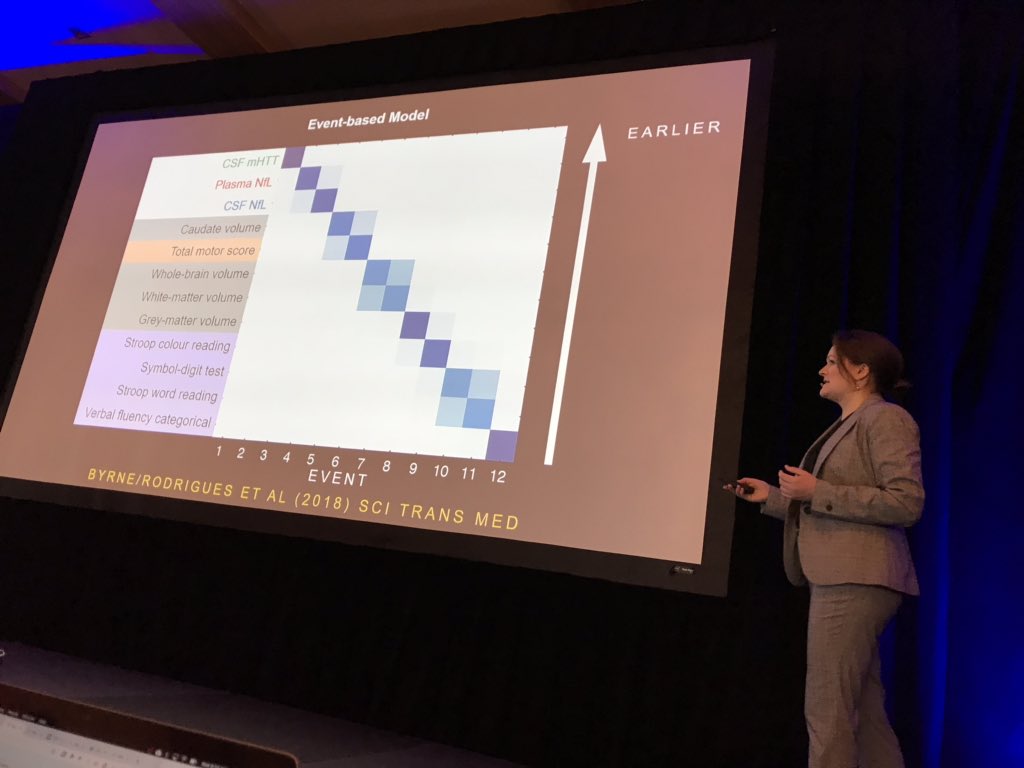
De eerste spreker vandaag is Lauren Byrne van UCL die biomarkers in bloed en hersenvocht (CSF) bestudeert. Byrne heeft bij 80 vrijwilligers het mutant Huntingtine in het hersenvocht gemeten, en neurofilament licht eiwit in het hersenvocht en in het bloed gemeten. Neurofilament licht of NFL is een eiwit dat wordt aangetroffen in neuronen en wordt afgegeven wanneer ze zijn beschadigd. Byrne deed ook MRI-scans om te zien hoe elke biomarker het krimpen van de hersenen voorspelt. Verrassend genoeg blijkt neurofilament een betere voorspeller van de mHTT van klinische symptomen en hersenvolume. Veranderingen in deze ‘biofluïde’ markers waren ook een van de vroegst waarneembare veranderingen, voorafgaand aan beeldvorming en klinische maatregelen in de volgorde van gebeurtenissen in de ZvH.
Byrne heeft nu het 2-jarige follow-up onderzoek van de ZvH-CSF-studie voltooid en toont aan dat de NFL lijkt te veranderen zoals verwacht in de tijd, en kan worden gemeten met een nieuw systeem dat vier moleculen tegelijk test.
De volgende is Amber Southwell, van UCF, die ook geïnteresseerd is in het ontwikkelen van hulpmiddelen om het gemuteerde huntingtine in het ruggenmergvocht te kwantificeren. Het team van Southwell toonde als eerste aan dat wanneer muizen worden behandeld met een Huntingtine-verlagende therapie – in het bijzonder een ASO van Ionis Pharma – de hoeveelheid gemuteerd Huntingtine in het ruggenmergvocht wordt verlaagd. Dit is belangrijk – het betekent dat wanneer we menselijke ZvH-patiënten behandelen met geneesmiddelen die Huntingtine verlagen, we zouden voorspellen dat het gehalte aan gemuteerd Huntingtine in het ruggenmergvocht zal dalen. Dit is een van de dingen die wetenschappers bedoelen als ze zeggen dat een meting een ‘biomarker’ is.
Het team van Southwell doet een coole reeks experimenten met muizen die geen Huntingtine hebben in specifieke soorten hersencellen. Dit stelt hen in staat om het exacte type hersencel in kaart te brengen dat verantwoordelijk is voor het vrijgeven van mutant Huntingtine in het ruggenmergvocht. Ze voeren ook nog een reeks experimenten uit die gericht zijn op het begrijpen van het exacte proces waardoor mutant Huntingtine zijn weg vindt van hersencellen, die neuronen worden genoemd, naar het ruggenmergvocht. Een proces van hersenspoeling genaamd “glymfatische klaring” lijkt waarschijnlijk een rol te spelen bij de weg die mutant Huntingtine aflegt naar het ruggenmergvocht.
Vervolgens is David Salzman van sRNAlytics aan de beurt. sRNAlytics is een bedrijf dat het gebruik van RNA onderzoekt om ziekten te bestuderen. RNA is de enkelstrengige neef van DNA. Cellen gebruiken RNA voor vele functies, vooral bekend als de ‘werkkopie’ van genen die ze willen inschakelen. Dat wordt messenger RNA genoemd. Daarnaast produceren cellen veel kleine RNA-moleculen die helpen bij de regulatie van genwisseling. Ze hebben namen als microRNA en er zijn veel verschillende soorten. We begrijpen goed dat genen werken als recepten voor eiwitten, maar micro-RNA’s zijn op dit moment nog erg mysterieus.

SRNAlytics identificeert patronen van kleine RNA-veranderingen en gebruikt kunstmatige intelligentie-algoritmen om te identificeren uit welk deel van het lichaam de RNA-veranderingen afkomstig zijn en hoe ze veranderen bij verschillende ziekten. Een groep van 60 kleine RNA’s in het hersenvocht kan blijkbaar met behoorlijke nauwkeurigheid onderscheid maken tussen de ZvH, Alzheimer’s en Parkinson’s. Twee kleine RNA’s zijn van bijzonder belang bij de ZvH, maar het is belangrijk om precies te begrijpen wat ze doen in gezonde en ZvH-hersenen om hun waarde als mogelijke biomarkers te achterhalen.
Nieuwe diermodellen
Guoping Feng, van MIT, is de volgende spreker. Zijn laboratorium werkt aan de ontwikkeling van nieuwe diermodellen van de ZvH. Hij zegt dat muizen erg nuttig zijn, maar ze hebben niet allemaal dezelfde hersengebieden als mensen, dus we moeten ook meer geavanceerde hersenen bestuderen. Vroeger was het moeilijk – en soms zelf onmogelijk – om primaten, zoals apen, genetisch te wijzigen, maar nieuwe hulpmiddelen voor genoomtechnologie maken het mogelijk. Met hulpmiddelen zoals CRISPR / Cas9 kunnen precieze DNA-bewerkingen worden aangebracht in het DNA van apenembryo’s. Het laboratorium van Feng is een van de beste in de wereld in het aanbrengen van veranderingen in primaten-DNA. Hij beschrijft dat ze van menselijke IVF-klinieken de beste manieren hebben geleerd om embryo’s van primaten gezond te houden. Feng’s laboratorium heeft een nieuw aapmodel van een genetische vorm van autisme gemaakt. Deze apen hebben zeer interessant gedrag dat echt lijkt op mensen met autisme, inclusief veranderd sociaal gedrag. Ze zijn nu bezig met het ontwikkelen van een aapmodel van de ZvH en hebben eerste experimenten uitgevoerd die suggereren dat het mogelijk zou moeten zijn.
Hideyuki Okano, van Keio University, werkt ook aan primaatmodellen van menselijke ziekten – met name Marmosets (een soort Zuid-Afrikaanse aap). Zijn laboratorium heeft genetisch gemodificeerde Marmosets met een vorm van de ziekte van Parkinson, die door een genetische mutatie wordt veroorzaakt. Deze dieren hebben symptomen die heel dicht in de buurt komen van die bij patiënten met de ziekte van Parkinson, waaronder een zeer uitdagende slaaptoestand genaamd REM-slaapgedragsstoornis (RBD). Ze hebben ook bewegings- en loopproblemen die lijken op de symptomen van patiënten met de ziekte van Parkinson. Het is een goed argument om geavanceerdere dieren te gebruiken om progressieve hersenziekten te modelleren. Het laboratorium van Okano ontwikkelt nu technieken om vergelijkbare modellen voor de ZvH te genereren.
Dat wat het voor vandaag! Bekijk ons verslag van dag 1 hier en wees er morgen bij voor de laatste samenvatting.
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


