Op zoek naar balans: hoe het huntingtine-eiwit compenseert bij de ZvH
Onderzoekers kijken naar oorzaak en gevolg van verschillende vormen van het HTT-eiwitten. Ze vinden dat zowel gemuteerd als niet gemuteerd HTT bijdraagt aan de communicatie tussen hersencellen.
Een groep onder leiding van Dr. Sandrine Humbert van het Franse Nationale Instituut voor Gezondheid en Medisch Onderzoek publiceerde nieuw werk in het prestigieuze tijdschrift Science. Haar team gebruikte coole wetenschap bij muizen om te bekijken hoe de gemuteerde zowel als de niet-gemuteerde kopie van het huntingtine (HTT) de ‘symptomen’ van de ziekte van Huntington (ZvH) bij de muis beïnvloeden. Laten we eens kijken naar de experimenten die ze deden en wat hun bevindingen suggereren.
Verschillende vormen van HTT dragen bij aan de ZvH
De genetische oorzaak van de ZvH is een extra stuk DNA in een gen genaamd huntingtin (HTT) dat leidt tot een gemuteerde vorm van het HTT-eiwit. De overgrote meerderheid van de mensen met de ZvH erven één kopie van het gen van hun ouder zonder de ZvH, en één gemuteerde kopie van hun ouder met de ZvH. Dit betekent dat voor een persoon met de ZvH de helft van hun HTT-eiwit volledig regulier en niet-gemuteerd is, terwijl de andere helft wel gemuteerd is.

Aangenomen wordt dat het gemuteerde HTT-eiwit de oorzaak is van huntingtongerelateerde symptomen. Er zijn echter vragen over welke problemen worden veroorzaakt door de aanwezigheid van dit eiwit, versus welke problemen worden veroorzaakt door de afwezigheid van voldoende niet-gemuteerd eiwit.
Om vragen over de balans tussen gemuteerd en niet-gemuteerde HTT-eiwitniveaus bij de ZvH te beantwoorden, kunnen onderzoekers een verscheidenheid aan genetische trucs gebruiken bij muizen. Ze manipuleren dan waar, wanneer en hoeveel HTT-eiwit wordt aangemaakt of ’tot expressie wordt gebracht’ in de hersenen en lichaam.
Eerder onderzoek op het gebied van de ZvH heeft aangetoond dat het tot expressie brengen van de gemuteerde kopie van het HTT-eiwit bij muizen, gedurende korte perioden tijdens de ontwikkeling, voldoende is om symptomen te veroorzaken die verband houden met huntington wanneer de muis ouder is. Maar wat ook interessant is, is dat hetzelfde gebeurt wanneer de normale, niet-gemuteerde kopie van HTT tijdens de ontwikkeling van de muis wordt verwijderd!
Het team van Dr. Humbert is onlangs begonnen met een diepgaander onderzoek naar de effecten van het verliezen of verkrijgen van verschillende vormen van HTT met behulp van gespecialiseerde huntingtonmuismodellen.
Communicatiestoornis
Hersencellen communiceren gedeeltelijk door het versturen van elektrische signalen doorheen het hele brein. Om hersenziekten te bestuderen, zullen onderzoekers deze elektrische signalen vaak meten om te zien hoe goed hersencellen met elkaar praten.
De groep van Dr. Humbert voerde experimenten uit om elektrische signalen te vergelijken in de zich ontwikkelende hersenen van muizen met of zonder gemuteerd HTT. Ze ontdekten verschillen in deze elektrische signalen als de muizen nog erg jong waren. De elektrische signalen stabiliseerden zich echter naarmate de muizen ouder waren en kwamen uiteindelijk overeen met deze van muizen met niet-gemuteerd HTT.
Dit lijkt erop te wijzen dat de hersenen in staat zijn om veranderingen in de communicatie tussen hersencellen die ze in het begin van de ZvH ervaren, te compenseren. De grote vraag is: houdt deze compensatie lang genoeg aan en dragen deze veranderingen bij tot huntingtongerelateerde symptomen die later in het leven worden ervaren?
“Het team van Dr. Humbert heeft echt cool onderzoek gedaan bij muizen om te kijken hoe zowel de geëxpandeerde als de niet-geëxpandeerde kopieën van huntingtine (HTT) de “symptomen” van de muis van de ziekte van Huntington (HD) beïnvloeden. ”
Oorzaak-en gevolg-raadsel
Huntingtononderzoekers hebben dit oorzaak-en gevolg-raadsel lang onderzocht, waarbij ze zich afvroegen of bepaalde symptomen geassocieerd met de ziekte worden veroorzaakt door de aanwezigheid van het gemuteerde HTT-eiwit of door het verlies van de normale variant.
De groep van Dr. Humbert vroeg zich af of het verkrijgen van gemuteerd HTT of het verliezen van niet-gemuteerd HTT de veranderingen veroorzaakt die ze zien in de communicatie tussen hersencellen in hun huntingtonmuizen. Ze gebruikten creatieve moleculaire hulpmiddelen om enkel de expressie van de reguliere HTT-kopie in zenuwcellen van de hersenen uit te schakelen.
Interessant is dat zenuwcellen met lagere hoeveelheden van het reguliere HTT-eiwit op dezelfde manier reageerden als degenen die het gemuteerde HTT-eiwit tot expressie brengen, behalve dat hun elektrische signalen in de loop van de tijd niet gelijk werden. Het lijkt er dus op dat de hersencellen zonder reguliere HTT het slechter deden dan die met gemuteerd HTT!
De onderzoekers denken dat dit betekent dat het HTT-eiwit nodig is voor communicatie tussen hersencellen wanneer muizen erg jong zijn, en de aanwezigheid van beide vormen (gemuteerd of regulier) helpt dit te compenseren naarmate muizen ouder worden.
HTT beïnvloedt de grootte en de vorm van zenuwcellen
Vervolgens keken de onderzoekers hoe de verschillende vormen van het HTT-eiwit de vorm van de zenuwcellen beïnvloeden. Zenuwcellen hebben de vorm van bomen – met een cellichaam dat aan de bovenkant veel takken bevat, een lange stam en een vertakt ‘wortelsysteem’ aan de onderkant van de cel.
Ze ontdekten dat zenuwcellen van muizen die de gemuteerde HTT-kopie tot expressie brachten minder complex waren en minder vertakkingen hadden toen de muizen erg jong waren. Naarmate de muizen echter ouder werden, werden ze qua grootte en vorm ingehaald om gelijk te worden aan zenuwcellen van muizen zonder de gemuteerde HTT-kopie.
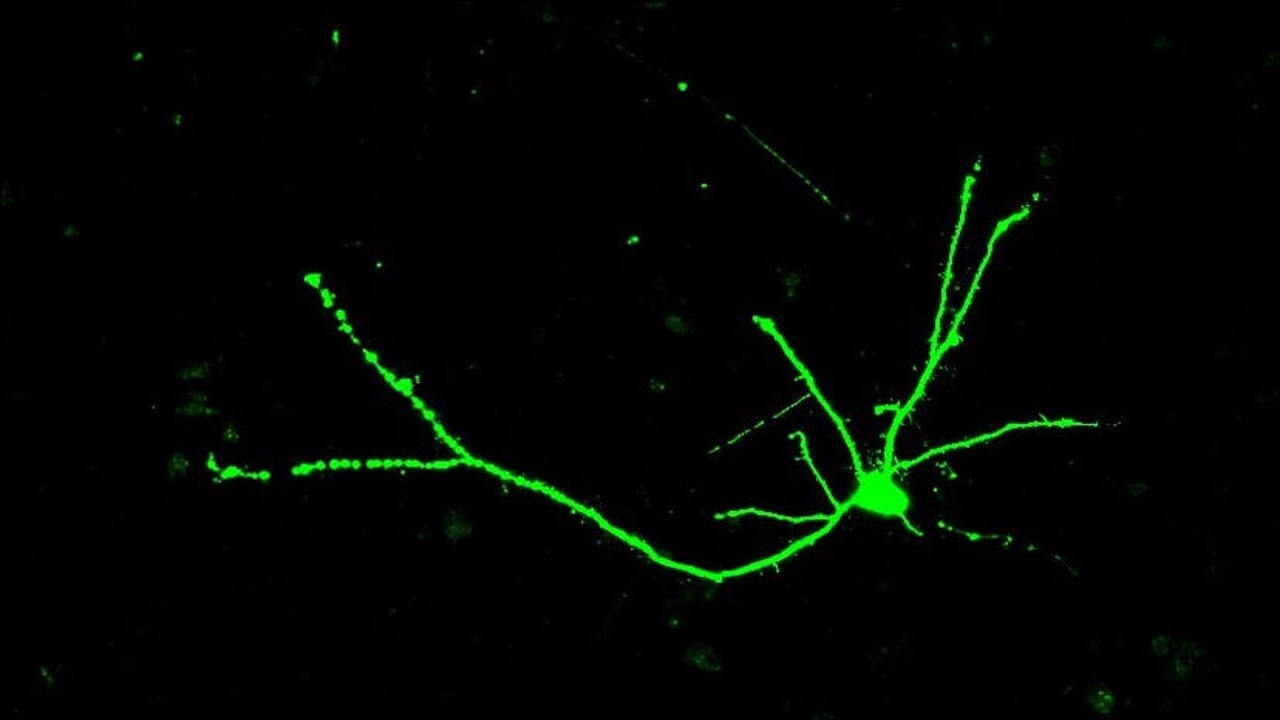
Image credit: Sarah Hernandez
Interessant is dat toen ze het experiment herhaalden de hoeveelheid reguliere HTT in zenuwcellen bij muizen verminderde, ze vergelijkbare bevindingen hadden als voorheen. Deze waren vergelijkbaar met wat werd waargenomen bij de huntingtonmuizen, behalve dat er geen compensatie was naarmate de muizen ouder werden. Dit suggereert nogmaals dat verlies van reguliere HTT grotere negatieve effecten veroorzaakt dan expressie van uitgebreide HTT!
Voor dit experiment voegden ze ook een medicijn toe, CX516 genaamd, dat het vermogen van zenuwcellen om elektrische signalen te verzenden vergroot. Dankzij sterke wetenschap voegden ze dit medicijn toe aan muizenembryo’s zonder HTT in de zenuwcellen,voordat ze werden geboren. Verrassend genoeg verbeterde dit medicijn de vorm en de grootte van de zenuwcellen. Dit suggereert dat verlies van het HTT-eiwit invloed heeft op de manier waarop cellen communiceren via elektrische signalen, maar wanneer dat wordt hersteld de hersenen dit kunnen compenseren!
Evenwicht is de sleutel
De volgende vraag die de onderzoekers stelden was of het verbeteren van de elektrische communicatie in huntington muizenhersenen met CX516 de ZvH ‘symptomen’ bij muizen zou beïnvloeden. Ze keken naar verschillende tests die het gedrag van muizen onderzoeken, zoals hoe goed muizen een open ruimte kunnen oversteken of hoe ze door doolhoven bewegen. Ze ontdekten dat CX516 verbeterde hoe de huntingtonmuizen deze taken uitvoerden.
Interessant is dat bij alle tests die naar de effecten van CX516 bij muizen zonder het reguliere HTT-eiwit keken, de muizen het slechter deden. Dus hoewel CX516 de elektrische communicatie tussen hersencellen verhoogt, lijkt het erop dat dit bij muizen zonder huntington schadelijk is. Deze resultaten benadrukken hoe delicaat de communicatiecircuits tussen cellen zijn en laten zien dat het ook slecht kan zijn om de weegschaal te ver in de andere richting te laten doorslaan.
Vermeldenswaard is dat CX516 niet zal onderzocht worden als een potentieel medicijn voor de ZvH. Het werd eerder bestudeerd als een mogelijke behandeling voor de ziekte van Alzheimer, maar werkte niet erg goed. Het is waarschijnlijker dat ze zullen kijken naar manieren om hersencelcommunicatie op dezelfde manier aan te pakken als CX516 dat doet, om beter te begrijpen hoe de hersenen huntingtongerelateerde veranderingen kunnen compenseren.
Compensatie van communicatietekorten
Er zijn een paar kanttekeningen bij dit werk. De eerste is dat CX516 aan de huntingtonmuizen werd gegeven voordat ze werden geboren. Dit leidt ongetwijfeld tot vragen over hoe vroeg we moeten behandelen om sommige van deze effecten te zien.
“De hersenen kunnen heel goed in compenseren! Er zijn veel overbodige paden die ervoor zorgen dat als er iets misgaat, andere mechanismen het goedmaken.”
Hoewel het lijkt alsof dit werk suggereert dat we mensen die gemuteerd HTT hebben moeten behandelen zodra ze geboren zijn, is dat misschien niet het geval. De hersenen zijn heel goed in compenseren! Er zijn veel overbodige paden die ervoor zorgen dat als er iets misgaat, andere mechanismen het goedmaken.
Dit is de reden waarom de experimenten in dit artikel een nivellering van elektrische signalen en veranderingen zagen in de grootte en de vorm van zenuwcellen naarmate de muizen ouder werden: de hersenen compenseerden. Dus het behandelen van de ZvH wanneer mensen volwassen zijn, kan de hersenen nog steeds de tijd geven om veranderingen gerelateerd aan HTT-expressie wanneer mensen jong zijn te compenseren.
Het tweede voorbehoud bij dit werk is dat muizen geen mensen zijn! Het zien van effecten bij muizen is geen garantie dat we hetzelfde bij mensen zullen zien.
Wat we hebben geleerd
In plaats van HTT-verlaging te bestuderen voor therapeutische doeleinden, verlaagde dit nieuwe werk van de groep van Dr. Humbert verschillende vormen van HTT als een hulpmiddel. Het stelde hen in staat een beter begrip te krijgen van de effecten veroorzaakt door verschillende vormen van het HTT-eiwit bij muizen. Studies zoals deze kunnen zeer informatief zijn voor therapieën gericht op het verlagen van HTT, waardoor we een vollediger beeld krijgen van wat er gebeurt in de ZvH.
Dit werk beschrijft ook enkele van de effecten veroorzaakt door de ziekte en de effecten die veroorzaakt worden omdat de hersenen deze proberen te compenseren. Het begrijpen van dat laatste stukje – hoe de hersenen compenseren – zou kunnen helpen om balans in de hersenen te vinden en behandelingen voor de ZvH te ontwikkelen.
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…