De ziekte van Huntington therapeutische conferentie 2020 Dag 3
HDBuzz rapporteert vanuit de jaarlijkse Ziekte van Huntington therapeutische conferentie in Palm Springs


Rachel en Sarah rapporteren vanuit de ziekte van Huntington Therapeutische Conferentie – de grootste jaarlijkse bijeenkomst van ZvH-onderzoekers.
Vergeet niet de verslagen van dag 1 en dag 2 terug te lezen.
Donderdagochtend- Huntingtine verlagen
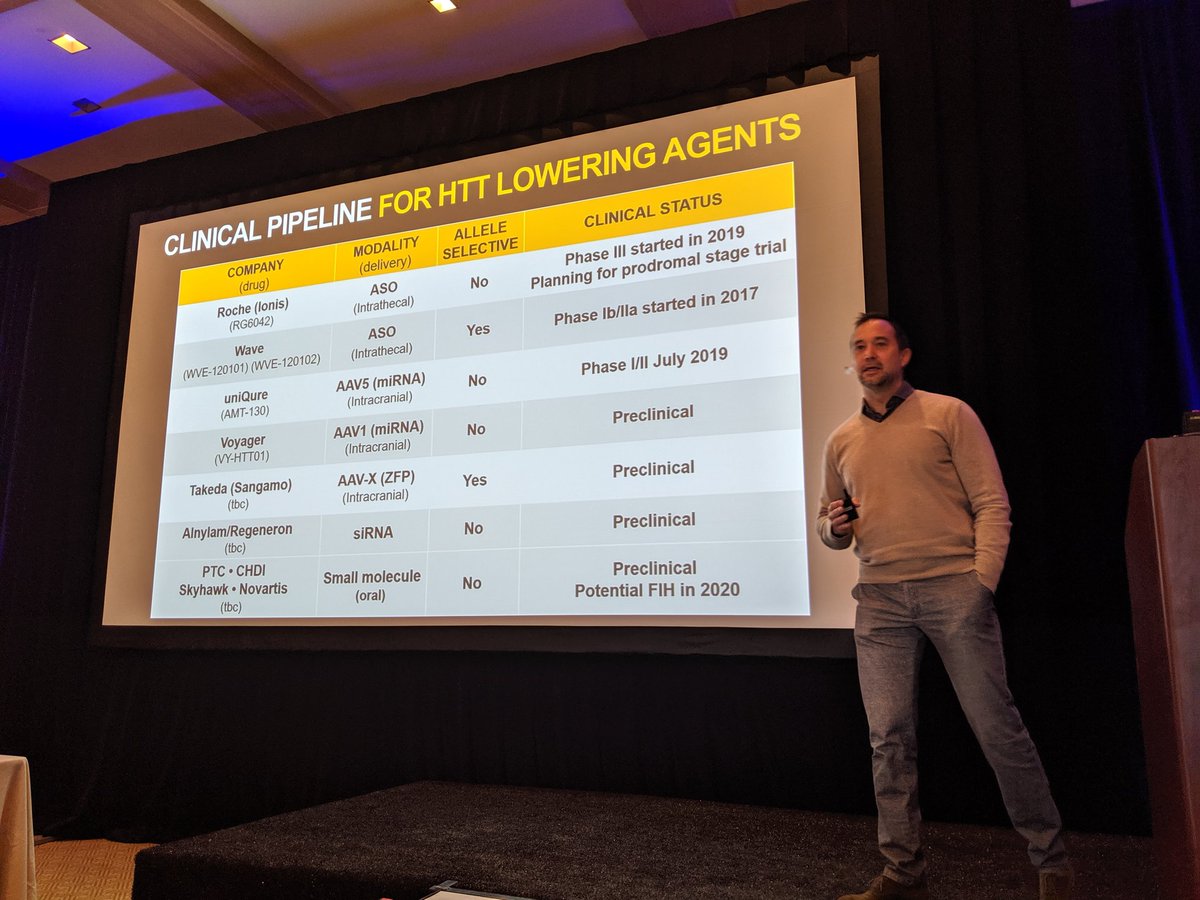
Goedemorgen allemaal! We zijn terug op de CHDI bijeenkomst in Palm Springs op dag 3, waar alles draait om huntingtine verlagen. Er zijn VEEL onderzoekers en bedrijven die geïnteresseerd zijn in het verlagen van huntingtine!
We weten dat het verlagen van huntingtine-eiwit (HTT) bij muizen en ratten helpt bij de symptomen en progressie van de ZvH, en dat het mogelijk is om HTT bij andere dieren te verlagen. De grote vraag blijft echter of we HTT bij mensen kunnen verlagen en of dit helpt bij de behandeling van patiënten. Andere grote vragen zijn wanneer we HTT moeten verlagen – moeten we dit doen voordat patiënten symptomen vertonen, of later? En moeten we HTT in specifieke hersengebieden verlagen? Of moet dit in het hele brein gebeuren? Allemaal zaken die de huidige klinische onderzoeken proberen te beantwoorden.
We kunnen er optimistisch over zijn dat klinische onderzoeken ons zullen helpen deze vragen te beantwoorden. Wetenschappers hebben veel manieren ontwikkeld om HTT te proberen te verlagen, evenals allerlei hulpmiddelen om HTT-niveaus in de hersenen te meten. Er zitten ook veel alternatieve strategieën in de pijplijn.
Onze eerste spreker is Ignacio Muñoz-Sanjuan van CHDI, die de timing van HTT-verlagingsstrategieën bespreekt. Muñoz-Sanjuan is ook zeer actief betrokken bij het bereiken van patiënten in Latijns-Amerika. Muñoz-Sanjuan startte een non-profitorganisatie welke zich inspant op het gebied van patiëntenbereik genaamd Factor H.
Wetenschappers willen ervoor zorgen dat alle therapieën die ze ontwikkelen veilig zijn voor patiënten. De ZvH beïnvloedt het hele lichaam, dus terwijl we ons concentreren op het verlagen van HTT in de hersenen, is het belangrijk om de effecten van de behandeling op de hele patiënt te begrijpen. Neurodegeneratie is een moeilijk probleem om aan te pakken – wetenschappers in andere domeinen zoals Alzheimer en Parkinson zijn ook bezorgd over hoe patiënten het beste kunnen worden behandeld. Het is geen gemakkelijke taak om deze nieuwe medicijnen te maken, dus we moeten voorzichtig blijven bij het vooruitgaan.
Een aantrekkelijk gebied voor het verlagen van HTT zijn kleine moleculen. Dit zijn medicijnen die als pil zouden worden ingenomen, dus veel mensen zijn erin geïnteresseerd om deze strategie verder te ontwikkelen. Maar dit zou waarschijnlijk niet specifiek gericht zijn op het teveel aan HTT, maar eerder op alle HTT. Een belangrijke vraag bij het verlagen van HTT is timing – wanneer moeten we behandelen om de ziekte te stoppen? Kunnen we eventuele schade ongedaan maken of kunnen we behandelen in latere ziektestadia? Onderzoekers willen patiënten geen onnodige medicijnen geven als dat niet hoeft. De hersenen zijn een heel complex orgaan en het is belangrijk om te onthouden dat muismodellen nuttig zijn voor het onderzoeken van bepaalde aspecten van de progressie van de ZvH, maar dat een muizenbrein geen menselijk brein is. Het gebruik van veel verschillende modellen van de ZvH is essentieel om te onderzoeken hoe goed medicijnen kunnen werken. Muizen zijn echter van cruciaal belang voor het bevorderen van ZvH-onderzoek. Omdat de timing van behandeling een hot topic is, volgen onderzoekers wat er gebeurt met het omkeren van cellulaire effecten bij muizen. Heel spannend; onderzoekers ontdekken dat verlaging van HTT in muizen, uitval in striatale neuronen – het meest aangetaste celtype in de hersenen van ZvH patiënten – kan voorkomen en omkeren – geweldig nieuws!
Nu gaan we over op de belofte van ZvH biomarkers. Om het nog eens kort samen te vatten: dit zijn metingen die wetenschappers bij patiënten kunnen doen om bij te houden hoe de ZvH vordert. Goede biomarkers kunnen clinici helpen informeren over hoe en wanneer ze patiënten het beste kunnen behandelen. CHDI heeft veel tijd besteed aan het ontwikkelen van nieuwe beeldvormende technieken waarmee we kunnen visualiseren hoeveel HTT er in de hersenen zit en waar het zich bevindt. Om dit te doen hebben ze een nieuw molecuul ontwikkeld dat specifiek bindt aan het HTT-eiwitmolecuul wanneer het zich vormt tot bepaalde klompstructuren. Dit wordt een PET-tracer of PET-ligand genoemd, omdat de scanners waarin het verschijnt PET-scanners worden genoemd – een afkorting voor positronemissietomografie. Het molecuul kan de hersenen binnendringen en kan dus worden gebruikt om de verlaging van HTT te volgen. CHDI en het team meten momenteel de verlaging van deze HTT-klonten in verschillende ZvH muismodellen. Ze proberen HTT te verlagen in verschillende delen van de muizenhersenen en behandelen daarbij ook muizen van verschillende leeftijden.
Een andere vraag die wetenschappers proberen te beantwoorden is hoeveel we het HTT-eiwit in cellen moeten verlagen? Welke mate kan de patiënten helpen behandelen? Welke niveaus zijn veilig? We kunnen het HTT PET-ligand en andere experimenten gebruiken om de verlagingsniveaus na behandeling te meten en kunnen vervolgens zien welke muismodellen herstellen bij welke verlagingsniveaus. Dit kan helpen bij het vertalen van ontdekkingen van muizen naar mensen.
De volgende spreker is Mark Bevan van de Northwestern University, die zijn werk over lagere HTT in een specifiek hersengebied bespreekt.
Het onderzoek dat Bevan vandaag met ons deelt is gericht op de manier waarop HTT-verlaging in bepaalde hersengebieden de manier waarop de hersenen werken kan veranderen, en hoe dit de symptomen bij patiënten kan beïnvloeden. Net als vele anderen is Bevan geïnteresseerd in celtypespecifieke verschillen veroorzaakt door de ZvH. Zijn groep constateert dat bepaalde soorten neuronen (hersencellen) minder actief zijn, terwijl andere niet worden beïnvloed in muismodellen van de ZvH. Door te kijken in ZvH-modellen van muizen heeft Bevan ontdekt dat er verschillen zijn in de manier waarop neuronen met elkaar praten, en gebruikt hij zijn experimenten om neuron-naar-neuroncommunicatie te bestuderen om het effect van het verlagen van HTT in deze muizen te bestuderen. Door het verlagen van HTT bij ZvH-muizen, ziet Bevan dat motorische problemen worden verbeterd – de muizen kunnen grotere afstanden met een hogere snelheid afleggen. Dit is goed nieuws, aangezien de huidige klinische onderzoeken bij mensen nog geen gegevens hebben vrijgegeven over veranderingen die ze mogelijk in symptomen zien. Bevan en collega’s blijven in hun muismodellen kijken naar het effect van het verlagen van HTT op andere motorische problemen. Ze hopen dat hun bevindingen kunnen helpen bij het vertalen van HTT-verlagende therapieën naar de kliniek.
De volgende spreker is Marcy MacDonald van het Massachusetts General Hospital, wiens lezing de intrigerende titel ‘De uiterste limieten’ draagt! Uit de Enroll-HD-studie ontdekken onderzoekers dat er veel variabiliteit is die afkomstig is van andere factoren dan de CAG-lengte. Hoewel dit een grote bevinding is op het gebied van de ZvH, geeft het echt aan hoe complex deze ziekte is, ook al kennen we de genetische oorzaak. Nogmaals grote dank aan alle Enroll-HD-deelnemers. Hopelijk heb je opgemerkt dat veel onderzoekers goed gebruik maken van de gegevens die je verstrekt – dank je! Hoewel iedereen het HTT-gen heeft en ZvH-patiënten een langere CAG hebben dan anderen, hebben we ook andere kleine variaties in de HTT-genherhaling waar onderzoekers zoals MacDonald geïnteresseerd in zijn om te bestuderen en aan te pakken met een therapie.
Het team van MacDonald heeft stapels gegevens gegenereerd over wat de ziekteprogressie bij de ZvH kan veranderen. Ze delen al hun gegevens zodat wetenschappers over de hele wereld eraan kunnen werken – vele paren ogen zien altijd meer dan één. Toevallig identificeerde MacDonald mensen met verminderde expressie van HTT. Deze mensen zijn prima in orde, dus onderzoekers weten dat het verlagen van HTT tot ten minste dat niveau geen nadelige effecten zou hebben. Omdat de expressieniveaus van HTT variëren binnen de bevolking en het goed met die mensen lijkt te gaan, is dit echt goed nieuws voor de strategieën voor het verlagen van HTT. Het suggereert dat het veranderen van HTT-niveaus mogelijk geen negatieve bijwerkingen heeft. Een ding om op te merken is dat wanneer HTT wordt verlaagd (met name in de lever), de cellen in muismodellen minder goed bestand zijn tegen stress. Dus nogmaals, het is erg belangrijk dat onderzoekers de veiligheid voor alle HTT-verlagende therapieën grondig testen.
Omdat HTT expressie niveaus variëren binnen de bevolking, moeten de onderzoekers zich er ook van bewust zijn dat het uitgangsniveau van HTT voor patiënten in HTT-verlagende onderzoeken kan verschillen. Men zou zich dus kunnen voorstellen dat in de toekomst voor elke patiënt een meer persoonlijke benadering wordt gekozen. Dit zijn allemaal punten die bedrijven die de verlagingsproeven van HTT uitvoeren in hun proefopzet overwegen. We kijken er allemaal naar uit om tijdens de middagsessie meer updates van deze proeven te horen.
Donderdagmiddag- Huntingtine-verlaging in de kliniek

Goedemiddag! Deze sessie richt zich op het vertalen van HTT-verlaging naar de kliniek. Onze eerste lezing is van Charlotte Sumner van Johns Hopkins. Ze zal enkele van de uitdagingen bespreken die verband houden met het therapeutisch aanpakken van genen.
Hoewel Sumner zich vooral richt op een andere neurodegeneratieve ziekte genaamd spinale musculaire atrofie (SMA), is er momenteel een ASO-behandeling (anti-streptolysin O behandeling) voor SMA, dus het ZvH-veld kan veel van hen leren. Net als bij de ZvH kennen we de precieze genetische oorzaken van SMA. Ons begrip van wat er gebeurt met de eiwitmoleculen in de cel is echter veel minder ver, dus de oorzaken van ziekte zijn niet helemaal duidelijk. Omdat de genetica bij SMA duidelijk is, zijn er een aantal verschillende gentherapieën voor ontwikkeld. Naast een goedgekeurde ASO-therapie zijn er ook kleine moleculen (ingenomen in een pil) die het doelgen verlagen, dit wordt momenteel beoordeeld door de FDA (kwaliteitscontroleur van medicatie in Amerika). Van een enkele dosis of ‘one-shot’ genvervangingstherapie die de DNA-sequentie rechtstreeks fixeert, is ook aangetoond dat het goed werkt bij jonge kinderen met SMA en er wordt gekeken of deze behandeling goed zou werken voor oudere patiënten. Sommige patiënten in de SMA-onderzoeken verbeterden dramatisch in verschillende gegevens die werden gemeten. Deze bevindingen zijn zeer bemoedigend voor ZvH-onderzoek, waar we enkele van de succesvolle strategieën die ze hebben gevonden op het gebied van SMA willen toepassen. Eerder op de conferentie tweetten we over onderzoekers die geïnteresseerd zijn in wanneer het beste moment is om de ZvH te behandelen. Op het gebied van SMA hebben ze gemerkt dat timing er echt toe doet, dus het is geweldig om te zien dat ZvH-onderzoek op de goede weg is.
Omdat sommige SMA-patiënten anders hebben gereageerd op behandelingen, willen SMA-onderzoekers graag meer patiëntgegevens krijgen om mogelijke redenen voor deze variatie te begrijpen. Dit versterkt waarom studies zoals Enroll-HD nuttig zullen zijn voor ZvH-onderzoek. Nu proberen SMA-onderzoekers uit te zoeken wat de beste manier is om hun patiënten te behandelen en te controleren, d.w.z. hoeveel van het geneesmiddel moet worden gegeven? Wanneer en hoe vaak moet het worden gegeven? Dit zou hopelijk de resultaten voor de patiënt verder moeten verbeteren. Nogmaals, net als bij de ZvH zijn SMA-onderzoekers geïnteresseerd in neurofilament als biomarker voor ziekteprogressie. Ze volgen de neurofilamentniveaus bij patiënten die worden behandeld met de verschillende SMA-therapieën en de neurofilamentniveaus lijken na verloop van tijd met de behandeling te dalen.
De volgende lezing is van Anastasia Khvorova die aan de University of Massachusetts Medical School werkt en ons zal vertellen over het verlagen van HTT met behulp van een techniek genaamd RNAi. Net als bij ASO’s, richten op RNAi gebaseerde therapieën zich op de boodschap van HTT in plaats van op het DNA of het eiwit, en werken ze om de middelste stap te vernietigen, zodat er nooit eiwit wordt geproduceerd. Je kunt hier meer lezen over RNAi en hoe het verschilt van ASO’s.
Om te testen hoe de op HTT gerichte RNAi de ziekte beïnvloedt, analyseerden Khvorova en haar team eerst de effecten bij muizen. De eerste stap was om te meten hoe hun behandeling zich in de hersenen verspreidde. Dat leverde veelbelovende resultaten op! Na een behandeling zagen ze dat HTT in veel delen van de hersenen aanzienlijk was verminderd. Dit werk was gericht op zowel verlengd als niet-verlengd HTT, maar ze werken ook aan benaderingen die alleen gericht zijn op verlengd-HTT. Door een aantal slimme aanpassingen aan de RNAi-moleculen te maken, konden Khvorova en het team hun behandeling selectief maken voor alleen het verlengde HTT-bericht, zodat alleen dit eiwit wordt verlaagd, en niet het niet-verlengde. Er moet echter worden opgemerkt dat dit alleen werkt bij ongeveer 35% van de patiënten die een klein verschil hebben in hun huntingtine-gensequentie, genaamd SNP (uitgesproken als ‘snip’). Hierdoor kan de RNAi-behandeling selecteren voor de verlengde in plaats van de niet-verlengde HTT. Vervolgens wilden ze zien hoe hun RNAi-behandeling zou werken in grotere diermodellen, dus gingen ze van muizen over op schapen. Met schapen testten ze verschillende toedieningsmethoden voor de behandeling die ze in de hersenen of het ruggenmergvocht konden injecteren en het werkt hetzelfde.
Na schapen gingen Khvorova en collega’s over op apen en zagen opnieuw dat de RNAi-behandeling zich redelijk mooi verspreidde over de hersenen en door het ruggenmerg. Het blijft ook vrij lang in deze regio’s, dus ze verwachten niet dat ze heel vaak hoeven te behandelen. In een vroeg veiligheidsonderzoek bij deze apen lijkt de therapie veilig bij de geteste dosis. Evenzo toonden de eerste gegevens van een veiligheidsonderzoek bij schapen dat de therapie veilig was onder de omstandigheden die de wetenschappers testten. Het goede nieuws is dat HTT in deze vroege studies bij apen aanzienlijk wordt verlaagd. De niveaus van andere genen lijken onveranderd, wat betekent dat de bijwerkingen laag lijken te zijn bij de metingen die de wetenschappers hebben gedaan. Desalniettemin is het zoeken naar zelfs kleine veranderingen in andere genen erg belangrijk, dus werken Khvorova en collega’s eraan om ervoor te zorgen dat daar geen veranderingen ontstaan en om de veiligheid van deze therapie te bevestigen. Deze technologie wordt door Khovrova en collega’s en door de CHDI als veelbelovend beschouwd. Het zou kunnen worden gebruikt om de niveaus van andere eiwitten in de hersenen te veranderen, zoals die welke zijn geïdentificeerd als zijnde invloed hebbend op wanneer symptomen starten bij de ZvH of andere doelen. Een van de dingen waar ze op letten, zijn de kosten. Ze proberen de kosten laag te houden, zodat de behandeling algemeen beschikbaar kan zijn voor alle ZvH-patiënten. We kijken erg uit naar meer updates over dit veelbelovende onderzoek terwijl zij richting klinisch gebruik gaan werken!
Onze volgende spreker is Astrid Valles-Sanchez van uniQure. Ze zal ons vertellen over UniQure’s benadering van het verlagen van HTT. UniQure heeft een behandeling genaamd AMT-130 om HTT te verlagen en voert momenteel een klinische proef uit om de veiligheid van deze behandeling te bepalen. AMT-130 is ontworpen als een eenmalige injectie van HTT-verlagende behandeling in de hersenen. Valles-Sanchez concentreert haar lezing op biomarkers die ze beoordelen om te meten hoe effectief deze behandeling zal zijn om de progressie van de ZvH te veranderen. Bij een varkensmodel zien ze dat hun behandeling tot 2 jaar in het ruggenmergvocht wordt gedetecteerd. Bij apen ontdekten ze dat hun behandeling tot 6 maanden werkte, toen de dieren werden opgeofferd. Net als bij andere onderzoeken wil uniQure controleren of hun therapie zich over de hersenen verspreidt om te zien waar het zou kunnen werken. In het varkensmodel, 12 maanden na de behandeling, analyseerden ze weefsel uit verschillende delen van de hersenen om te zien hoe effectief hun behandeling HTT verlaagde. Ze vonden een significante verlaging van het verlengd HTT met de sterkste verlaging in hersenregio’s die het meest worden aangetast door de ZvH. UniQure keek ook naar verlengde HTT-niveaus in het ruggenmergvocht na behandeling van ZvH-varkensmodellen met AMT-130, maar in dit specifieke experiment correleren de niveaus in het ruggenmergvocht niet met de niveaus van HTT in de hersenen. Wetenschappers van uniQure zijn geïnteresseerd in het gebruik van magnetische resonantiespectroscopie (MRS), een niet-invasieve manier om naar de hersenen te kijken. Dit om te zien of er veranderingen zijn in chemicaliën, metabolieten genaamd, die na behandeling in verschillende delen van de hersenen worden aangetroffen.
Het laatste gesprek van de conferentie is van Scott Schobel, die ons zal vertellen over enkele zeer voorlopige nieuwe resultaten van de Roche-proef. Deze resultaten zijn afkomstig van een open-label verlenging van 15 maanden bij manifeste (symptomatische) ZvH-patiënten. We moeten een beetje voorzichtig zijn bij het interpreteren van deze gegevens omdat ze nog in de kinderschoenen staan, maar het is desalniettemin spannend om te zien wat ze hebben gevonden.
Zoals veel projecten op het gebied van ZvH-onderzoek, is dit een grote gezamenlijke inspanning geweest van veel onderzoekers die samenwerken om dit naar buiten te brengen. RG6042 heeft een nieuwe naam! Het heet tominersen, en vanaf nu zal de therapie zo heten. Patiënten in het oorspronkelijke veiligheidsonderzoek werden op een open-label extensie gehouden, wat betekent dat ze na het beëindigen van de veiligheidsstudie de therapie bleven ontvangen en de gegevens die we vandaag zullen zien, zijn wat wetenschappers hebben gevonden sinds het einde van het veiligheidsonderzoek. Samenvattend – deze therapie is NIET selectief voor het verlengde HTT-gen, het is ontworpen om zowel het verlengde als het niet-verlengde huntingtine-eiwitniveau te verlagen. Mensen bij Roche en hun medewerkers werken nu al vele jaren met verschillende diermodellen om erachter te komen hoeveel ze nodig zouden hebben om de niveaus van huntingtine-eiwit te verlagen en hoe ze die verlaging van eiwit zouden kunnen meten door naar het ruggenmergvocht te kijken. Het was twee jaar geleden op de CHDI-bijeenkomst dat Sarah Tabrizi van UCL de eerste resultaten van de veiligheidsstudie leverde. In slechts 2 korte jaren hebben we enorme vooruitgang geboekt op het gebied van HTT-verlaging en er zijn nu veel strategieën beschikbaar – erg spannend!
Uit de veiligheidsstudie bleek dat het HTT-eiwitgehalte met tominersen op een dosisafhankelijke manier kon worden verlaagd. Dit betekent dat het eiwit meer werd verlaagd bij patiënten die meer van de behandeling kregen in het kleine aantal geteste patiënten. De open-label extensie testte 2 doseringsstrategieën – deelnemers kregen ofwel elke maand ofwel om de maand een dosis. Dit type ontwerp was van cruciaal belang om te bepalen hoe vaak patiënten tominersen zouden moeten gebruiken. Ze ontdekten dat een goede verlaging van huntingtine werd waargenomen, zelfs wanneer tominersen om de maand werd ingenomen. De twee patiëntengroepen hadden maar heel weinig mensen die dit vervolgonderzoek niet voltooiden – we zijn deze patiënten allemaal dankbaar voor hun inzet voor het onderzoek! Gezien de meetgegevens die Roche onderzocht, geven de gegevens aan dat tominersen om de maand moet worden ingenomen in plaats van elke maand. Omdat ze ontdekten dat de minder frequente dosering effectief was bij het verlagen van HTT, pasten ze de strategie voor de volgende tak van het onderzoek (fase III) aan om het aantal doses en testdoseringen elke 16 weken te verminderen – dit is veel minder veeleisend voor patiënten!
Het volgen van niveaus van neurofilament, een voorgestelde ZvH biomarker om ziekteprogressie te volgen, zou nuttig kunnen zijn om te zien hoe effectief de behandeling is. Roche gaat door met het onderzoeken van neurofilament niveaus in de klinische studie. Ze ontdekten dat de NfL-niveaus eerst stijgen, maar daarna lijken af te nemen en zelfs af te vlakken na 15 maanden. Roche is geïnteresseerd in het nog beter begrijpen van de NfL-biomarker en onderzoekt de onderliggende biologie die HTT en NfL met elkaar verbindt. Er zit meer klinisch werk in de pijplijn bij Roche dat hopelijk de ZvH-onderzoekers zal blijven informeren over hoe effectief deze therapie zou kunnen zijn. Schobel heeft zijn dia’s vriendelijk online gedeeld!
En dat is voor de ZvH Therapeutische Conferentie van dit jaar! Zorg ervoor dat je Dag 1 hier en Dag 2 hier kijkt en blijf op de hoogte van het gesprek op Twitter. We kijken al uit naar volgend jaar!
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…