Spannend nieuw hulpmiddel voor Huntingtine-verlaging beschreven
Spannend nieuw werk op het gebied van Huntingtine-verlaging van @SangamoTx en @CHDIfoundation met gebruik van “Zinc Fingers” om de expressie van het gemuteerde Huntingtine-gen uit te schakelen. Meer details over deze spannende nieuwe techniek hier.

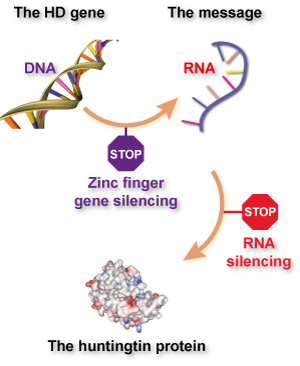
Er is zojuist een spannend nieuw hulpmiddel in de strijd tegen de ziekte van Huntington beschreven. Een internationale groep wetenschappers heeft een nieuwe, gerichte manier ontwikkeld om de niveaus van het gemuteerde huntingtine-eiwit te verlagen.
Huntingtine-genetica: van gen tot eiwit
De ziekte van Huntington (ZvH) wordt veroorzaakt door een genetische verandering – of mutatie – in het DNA van een specifiek gen. Wetenschappers noemen dit gen
Die vier DNA-letters worden aangeduid met afkortingen van hun chemische namen: ‘A’, ‘C’, ‘T’ en ‘G’. Elke vorm van ZvH wordt veroorzaakt door een verlenging van een lange reeks DNA-letters ‘C-A-G’ vlakbij het begin van het huntingtine-gen. Bij de meeste mensen – degenen die geen ZvH zullen ontwikkelen – wordt die ‘C-A-G’-code ongeveer 20 keer herhaald, om redenen die we nog niet helemaal begrijpen.
ZvH ontstaat wanneer iemand een verlengde reeks ‘C-A-G’ erft, waarbij de ziekte onvermijdelijk ontstaat bij mensen die 40 of meer ‘C-A-G’s’ erven. Let op dat iedereen twee verschillende kopieën van het huntingtine-gen heeft – één geërfd van mama en één van papa. De overgrote meerderheid van ZvH-patiënten heeft een normale kopie met een laag aantal ‘C-A-G’s’, en de gemuteerde kopie waarin ze langer zijn.
De meeste genen, inclusief het huntingtine-gen, worden door cellen gebruikt als handleiding voor het bouwen van eiwitten – kleine moleculaire machines die cellen helpen hun werk te doen. Dus in de cellen van mensen met de ZvH-mutatie zijn er twee verschillende versies van het huntingtine-gen, en die instructies vertellen de cel om twee verschillende versies van het huntingtine-eiwit te maken.
Huntingtine-verlaging
Een belangrijk doel van de ZvH-onderzoekswereld is momenteel om te onderzoeken of “huntingtine-verlagende” strategieën effectieve behandelingen kunnen zijn voor ZvH. Het doel van huntingtine-verlagende behandelingen is om de snelheid waarmee cellen de informatie in het huntingtine-gen gebruiken om het huntingtine-eiwit te maken, te stoppen of te vertragen.
Dierstudies suggereren dat als we de hoeveelheid huntingtine-eiwit die wordt gemaakt van het gemuteerde huntingtine-gen kunnen verlagen, we mogelijk de symptomen van ZvH kunnen verminderen. Een aantal farmaceutische bedrijven gebruikt een breed scala aan benaderingen om huntingtine te verlagen als mogelijke nieuwe behandelingen voor ZvH. We hebben het algemene idee van huntingtine-verlaging hier behandeld, met recentere updates over huntingtine-verlagende medicijnen genaamd ASO’s hier en hier, en andere benaderingen hier en hier.
En nu, ZFP’s
Het biotechnologiebedrijf Sangamo Therapeutics werkt al een aantal jaren aan nog een andere manier om eiwitten te verlagen: door te controleren of een gen wordt aangezet of geactiveerd. Hun technologie is gebaseerd op kleine moleculaire machines genaamd zinkvingerproteïne transcriptiefactoren. Dat is nogal een mondvol, dus we noemen ze voor het gemak
Hoewel het basisidee hetzelfde is, werken ZFP’s op een heel unieke manier, vergeleken met bestaande huntingtine-verlagende technologieën. Bestaande huntingtine-verlagende medicijnen werken door zich te richten op een tussenstap tussen het lezen van de huntingtine-geninformatie uit DNA en het maken van het huntingtine-eiwit. De informatie in genen wordt eerst gelezen van het DNA, gekopieerd in een nauw verwante taal genaamd RNA en vervolgens vertaald in de taal van eiwitten. Dit tussenliggende RNA-bericht is het doelwit van huntingtine-verlagende medicijnen die momenteel in de kliniek worden gebruikt.
Maar ZFP’s, zoals die ontwikkeld door Sangamo en hun medewerkers, werken op een heel andere manier. Onze cellen bevatten een aantal eiwitten met kleine pincetjes, die precies de juiste vorm hebben om specifieke DNA-sequenties vast te pakken. (Nerd-alert – de pincetjes worden bij elkaar gehouden door een zinkatoom, wat de grappige naam verklaart).
“Anders dan bij benaderingen die zich richten op het huntingtine-RNA, zetten cellen die behandeld zijn met ZFP’s hun huntingtine-gen nooit aan in de eerste plaats.”
ZFP’s voor ZvH?
Gedurende vele jaren hebben onderzoekers gewerkt aan het begrijpen van natuurlijk voorkomende ZFP’s in de hoop dat ze deze konden herprogrammeren om aan nieuwe specifieke DNA-sequenties te hechten. Sangamo is een leider geweest op dit gebied en heeft een soort gereedschapskist ontwikkeld van aangepaste ZFP’s die zich kunnen richten op bijna elke DNA-sequentie.
Waarom dit doen, wat is het nut van het maken van aangepaste DNA-bindende pincetjes? Nou, het blijkt dat we verschillende ladingen aan deze pincetjes kunnen bevestigen, en sommige daarvan doen zeer interessante dingen met het DNA waar ze zich aan hechten. Als voorbeeld weten onderzoekers dat ze een soort cellulair stopbord kunnen fuseren met zinkvingers, om de cel te blokkeren het gerichte gen te activeren.
Een recente publicatie beschrijft Sangamo’s werk aan de ontwikkeling van ZFP’s voor gebruik bij ZvH, wat een grootschalige samenwerking was met de CHDI-stichting en een aantal ZvH-onderzoekers wereldwijd. Na een arbeidsintensieve screening waren ze in staat om nieuwe ZFP’s te ontwikkelen die zich hechten aan het huntingtine-gen – in het DNA – en de activering ervan blokkeren. Dus, anders dan bij andere benaderingen die zich richten op het huntingtine-RNA, zetten cellen die met deze ZFP’s behandeld zijn hun huntingtine-gen nooit aan in de eerste plaats.
Nog beter, het team was in staat om ZFP’s te ontwikkelen die alleen de expressie van de gemuteerde kopie van het huntingtine-gen kunnen uitschakelen, terwijl de normale kopie volledig met rust wordt gelaten. Sangamo testte hun vermogen om onderscheid te maken tussen een van de laagste CAG-groottes die ZvH bij mensen veroorzaken (38 CAG-herhalingen), terwijl ze de normale kopie van huntingtine met rust lieten.
Veelbelovende resultaten bij muizen
Nadat ze in cellen hadden bewezen dat hun nieuwe ZFP’s specifiek gemuteerd huntingtine konden uitschakelen, deed het team vervolgens een aantal zeer goed uitgevoerde dierstudies om te zien of hun hulpmiddel nuttig zou kunnen zijn in de hersenen van dieren met ZvH-achtige mutaties. Om volledig te zijn, testten ze twee verschillende diermodellen van ZvH – één met zeer snel voortschrijdende symptomen, en een ander met meer subtiele langetermijnveranderingen.
In beide gevallen leidde ZFP-toediening aan de hersenen van muizen tot vermindering van het huntingtine-eiwit. Het hielp ook bij enkele van de symptomen die deze muizen ervaren, die een beetje lijken op wat we waarnemen bij ZvH-patiënten.
Het is redelijk eenvoudig om experimentele medicijnen zoals deze te testen bij muizen. Onderzoekers kunnen hersenweefsel van dieren verzamelen en het intensief bestuderen, maar vergelijkbare studies zijn onmogelijk bij menselijke ZvH-patiënten, die behoorlijk chagrijnig worden als je stukjes van hun hersenen wegneemt. Omdat het vertalen van muizenstudies naar mensen zo moeilijk is, deed het team nog een reeks experimenten om te bepalen of ZFP-behandeling dingen verbeterde op een manier die we ook bij mensen kunnen meten.
In feite kon het team met geavanceerde hersenscanningtechnieken de voordelen van ZFP-behandeling bij ZvH-muizen waarnemen. Deze goed gevestigde technieken werken ook bij mensen, dus als we ZFP’s in menselijke studies willen testen, kunnen we hopen op verbeteringen te zoeken zonder dat we weefsel hoeven te verwijderen.

Wat zijn de risico’s en voordelen van ZFP’s?
Zoals bij elke andere potentiële behandeling voor ZvH, zijn er voordelen en nadelen aan het gebruik van ZFP’s. In theorie is het een veel betere aanpak om de eiwitproductie van een gemuteerd gen volledig uit te schakelen, in plaats van te proberen het RNA en eiwit achteraf op te ruimen. We begrijpen niet volledig welke RNA- en eiwitsoorten toxische effecten hebben in cellen, dus het bij de bron uitschakelen lijkt de beste aanpak.
Bovendien laten de gegevens die door Sangamo en hun medewerkers worden gepresenteerd een zeer goed vermogen zien om onderscheid te maken tussen de normale kopie van het huntingtine-gen en de gemuteerde kopie. Het uitschakelen van alleen de gemuteerde kopie van het huntingtine-gen en het sparen van de andere kopie is, in theorie, te verkiezen, aangezien we nog steeds niet elk risico kennen dat verbonden is aan het verminderen van de normale kopie.
Aan de andere kant zijn de ZFP’s die door Sangamo en hun medewerkers zijn ontwikkeld zelf genen, gecodeerd in DNA, die moeten worden afgeleverd aan elke cel die we willen behandelen. Het gebruik van genaflevering om een ziekte te behandelen staat algemeen bekend als gentherapie. Om een effectieve behandeling voor ZvH te zijn, zal ZFP-gentherapie bepaalde interventies vereisen. Het DNA dat codeert voor de ZFP’s moet worden verpakt in een virus en in de hersenen worden geïnjecteerd.
Zoals elk medicijn zouden de ZFP’s die door Sangamo en hun medewerkers zijn ontwikkeld onverwachte gevolgen kunnen hebben. In dit geval zou de eenvoudigste zorg over ZFP’s kunnen zijn dat ze per ongeluk andere genen – naast huntingtine – als doelwit hebben voor verlaging. Het team heeft in cellen vrij gedetailleerd onderzoek gedaan naar deze mogelijkheid, maar natuurlijk kunnen dingen in de hersenen ingewikkelder zijn.
De beste manier om te bepalen of deze ZFP’s zo nuttig zijn als we zouden hopen, is om menselijke studies uit te voeren. Om dit te ondersteunen heeft Sangamo een partnerschap opgezet met de Japanse farmaceutische gigant Takeda, die zeker de expertise en middelen hebben om dergelijke studies uit te voeren. Blijf HDBuzz volgen voor aankondigingen over toekomstige studies met ZFP’s bij ZvH-patiënten.
Conclusie
Deze spannende nieuwe studie biedt nog een pijl in onze koker terwijl we huntingtine-verlaging in de kliniek aanpakken. De studie was zeer goed uitgevoerd en laat ons goed voorbereid achter om ZFP’s te overwegen voor tests in menselijke klinische studies. Het is zeer spannend om te zien dat briljante wetenschappers over de hele wereld nieuwe benaderingen blijven ontwikkelen om ZvH te behandelen.
Deze nieuwe ZFP’s lijken waarschijnlijk spannende voordelen te bieden vergeleken met andere Huntingtine-verlagende benaderingen die we graag getest zien worden bij ZvH-patiënten. Blijf HDBuzz volgen voor meer berichtgeving over huntingtine-verlagende therapieën!
Meer informatie
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


