
Nieuwe tool om resultaten te meten in klinische studies naar de ziekte van Huntington
Een betere tool voor HD-studies! Nieuw onderzoek toont innovatieve manier om mutant Huntingtine buiten de hersenen te meten
Als patiënten deelnemen aan klinische studies, moet er een soort meetmethode zijn om te bepalen of de nieuwe behandeling werkt. Het is belangrijk om twee dingen te weten: Wat te meten en hoe het te meten. Bij HD worstelen wetenschappers en artsen al jaren met deze obstakels. Het nieuwste onderzoek komt met een slimme nieuwe aanpak om beide uitdagingen op een nieuwe manier aan te pakken. Deze resultaten kunnen een waardevolle tool bieden voor het bestuderen van nieuwe HD-therapieën in klinische studies.
Wat te meten en hoe te meten: Het lijkt eenvoudig. En soms is dat ook zo. Om bijvoorbeeld een nieuw cholesterolverlagend medicijn te testen, nemen artsen na de behandeling bloed af bij patiënten, meten het cholesterol en vergelijken dit met de waarden van vóór de behandeling. In dit geval is het wat duidelijk (cholesterol), en het hoe is eenvoudig omdat cholesterol een grote, vetachtige stof is die gemakkelijk uit bloed kan worden geïsoleerd en gemeten.
Maar bij klinische studies naar HD zijn wat en hoe veel ingewikkelder.
Afbeelding: Wikicommons
Het “Wat”
HD wordt veroorzaakt door een genetische mutatie die de samenstelling van het Huntingtine-eiwit verandert, waardoor het eiwit toxisch wordt. Dit gemuteerde Huntingtine-eiwit dat zich misdraagt in neuronen veroorzaakt elk geval van HD. Mutant Huntingtine verstoort veel vitale neuronale functies, waaronder transport van celmateriaal, genregulatie en energieproductie.
Mutant Huntingtine bevindt zich normaal gesproken in cellen, waaronder hersencellen. Maar het meten van mutant Huntingtine in de hersenen vereist een hersenbiopsie – niet ideaal als je het kunt vermijden. Daarom wordt er gezocht naar minder invasieve manieren om dit lastige eiwit te kwantificeren.
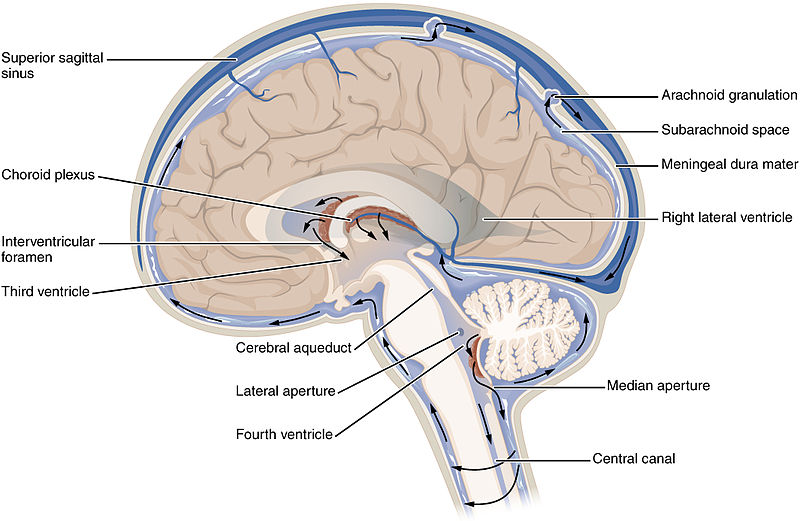
Weet je nog dat ik net zei dat Huntingtine normaal gesproken in hersencellen wordt gevonden? Nou, dat is niet altijd het geval. Soms komt mutant Huntingtine vrij – mogelijk als gevolg van stervende neuronen. Als een hersencel sterft, breken de membranen af, waardoor de inhoud naar buiten lekt. Dit betekent dat veel mutant Huntingtine dat ooit in de cel zat nu vrij is. De hersenen ruimen de rommel van de stervende cel snel op – maar voordat het wordt afgebroken, reist een deel van de inhoud door de vloeistof die de hersenen omgeeft, het cerebrospinale vocht genoemd.
De cerebrospinale vloeistof circuleert door de hersenen en het ruggenmerg. Artsen kunnen een dunne naald in de ruimte onder het ruggenmerg inbrengen en kleine hoeveelheden cerebrospinaal vocht afnemen. Door de vloeistof te analyseren, krijgen artsen een kleine inkijk in wat er in de hersenen gebeurt zonder een hersenbiopsie.
“Toen de cellen begonnen af te sterven, zagen ze een scherpe piek in de mutant Huntingtine-niveaus in het cerebrospinale vocht.”
Een nieuwe studie van Dr. Amber Southwell, Michael Hayden en collega’s vraagt: “Kunnen we mutant Huntingtine-niveaus in cerebrospinaal vocht meten en deze gebruiken om ons iets te vertellen over de niveaus van mutant Huntingtine in de hersenen?” En het antwoord is ja!
Onderzoekers hebben drie bewijsstukken die deze spannende nieuwe ontdekking ondersteunen.
Ze begonnen met het meten van mutant Huntingtine-eiwit in het cerebrospinale vocht van HD-mutatiedragers. Ze namen monsters af bij mutatiedragers in verschillende stadia van de ziekte: gevorderd, vroeg-midden, en voordat symptomen verschenen. De onderzoekers wilden zien of de niveaus van mutant Huntingtine in cerebrospinaal vocht toenemen naarmate de ziekte vorderde.
Zoals ze voorspelden, waren de niveaus van mutant Huntingtine in cerebrospinaal vocht het hoogst bij mensen in gevorderde stadia van de ziekte, en lager in vroege ziektestadia. Waarom dit zo is, is niet duidelijk – het kan zijn dat omdat er meer hersencellen sterven in het verloop van HD, er meer mutant Huntingtine-eiwit vrijkomt, maar meer studies zijn nodig om te zien of dit het geval is.
Hoewel die correlatie veelbelovend was, wilden onderzoekers een stap verder gaan om te bevestigen dat stervende hersencellen echt de bron waren van mutant Huntingtine in cerebrospinaal vocht. Dus wendden ze zich tot muizen.
Onderzoekers vergiftigden een klein gebied van hersencellen. Toen de cellen begonnen af te sterven, zagen ze een scherpe piek in de mutant Huntingtine-niveaus in het cerebrospinale vocht. Dit zou kunnen komen doordat de stervende cellen hun inhoud in de hersenen lekken, en een deel van die inhoud, waaronder mutant Huntingtine, in de CSF terechtkomt.
Afbeelding: Protein Data Bank
Huntingtine Onderdrukkende Tools
Een van de nuttigste toepassingen van het meten van mutant Huntingtine in cerebrospinaal vocht zou het testen van nieuwe HD-therapieën zijn. Een veelbelovende onderzoeksrichting is het direct verlagen van de niveaus van mutant Huntingtine-eiwit. Een nieuwe vorm van HD-therapie, genonderdrukking genoemd, is bijvoorbeeld gericht op het vertragen of stoppen van ziekteprogressie door de niveaus van mutant Huntingtine te verlagen. (Klik hier voor een HDBuzz-artikel over genonderdrukking: http://en.hdbuzz.net/023).
Als proof of concept behandelden onderzoekers HD-modelmuizen met genonderdrukkende medicijnen waarvan bekend is dat ze mutant Huntingtine-niveaus in de hersenen verlagen. Toen ze monsters namen van de gen-onderdrukte dieren, ontdekten ze dat de niveaus van mutant Huntingtine in het cerebrospinale vocht ook waren verlaagd! Dit suggereert dat het meten van mutant Huntingtine in cerebrospinaal vocht een goede indicator kan zijn om te meten of genonderdrukkende medicijnen in HD klinische studies werken.
Het “Hoe”
Het idee om mutant Huntingtine in cerebrospinaal vocht te meten bestaat al een tijdje, maar het vormt een enorme technische uitdaging. Zoals uitgelegd in dit HDBuzz-artikel (
“onderzoekers die menselijke genonderdrukkingsstudies plannen hebben een krachtige nieuwe tool om te zien hoe goed deze medicijnen werken”
Maar de andere belangrijke ontdekking uit dit artikel is een nieuwe, ultragevoelige methode om mutant Huntingtine in cerebrospinaal vocht te meten.
De techniek gebruikt een paar eiwitten genaamd antilichamen die specifiek mutant Huntingtine herkennen en zich eraan hechten, en niet aan andere eiwitten in cerebrospinaal vocht. De antilichamen zijn zelfs zo specifiek dat ze alleen toxisch mutant Huntingtine herkennen, en niet het normale, gezonde Huntingtine, dat ook wordt geproduceerd in HD-patiënten. Belangrijk is dat het mutant Huntingtine kan identificeren dat los door het cerebrospinale vocht zweeft of gebonden is aan andere eiwitten in multi-eiwitklonters, waar het zich meestal bevindt.
Een van de antilichamen in het paar is bevestigd aan een extreem klein bolletje, en het andere is bevestigd aan een lichtgevend label. De antilichamen pakken mutant Huntingtine vast. Vervolgens worden de bolletjes verzameld, waarbij ze mutant Huntingtine meeslepen. Ten slotte worden de bolletjes plus mutant Huntingtine door een speciale machine gevoerd die het licht van het label kan detecteren, waardoor de hoeveelheid mutant Huntingtine kan worden gekwantificeerd. (Meer gloed = meer antilichaam = meer mutant Huntingtine.) Deze combinatie van zeer specifieke antilichamen en zorgvuldige meting van gloeiend licht gaf clinici en onderzoekers een andere betrouwbare tool om mutant Huntingtine in cerebrospinaal vocht te meten.
Deze nieuwe techniek vult een andere recent beschreven techniek aan die vergelijkbare methoden gebruikt en vergelijkbare resultaten vond (http://en.hdbuzz.net/197). Deze nieuwe studie levert spannend genoeg het eerste bewijs dat het mutant Huntingtine-eiwit dat in de CSF wordt gemeten, afkomstig is uit de hersenen, waarschijnlijk van stervende cellen. Het belangrijkste is dat behandeling van hersenen met medicijnen die mHTT-niveaus verlagen, leidt tot snelle veranderingen in CSF-niveaus.
Dit betekent dat, welke van deze nieuwe technieken ook wordt gebruikt om HTT te meten, onderzoekers die menselijke genonderdrukkingsstudies plannen een krachtige nieuwe tool hebben om te zien hoe goed deze medicijnen werken. We zijn behoorlijk enthousiast over deze studies, waarvan de eerste nu net begint, en deze techniek is een krachtige nieuwe aanvulling op het testen van deze medicijnen bij HD-patiënten.
Meer informatie
Bronnen & Referenties
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


