Aankondiging klinische studie ziekte van Huntington: huntingtine-verlagend medicijn start Fase I-studie in 2015
Een klinische studie voor een veelbelovende therapie tegen HD is gepland voor 2015. De eerste stap is ervoor zorgen dat het veilig is.

Een nieuwe klinische studie die zojuist is aangekondigd voor 2015 heeft als doel een “huntingtine-verlagende” therapie te testen, genaamd een antisense oligonucleotide (ASO), die het mutante huntingtine direct aanvalt. We zijn enorm enthousiast—het is de allereerste menselijke HD-studie die HD bij de wortel van het probleem aanpakt, en heeft veel belofte getoond in diermodellen. Wat is het verhaal?
Een potentieel medicijn gericht op het HD-gen
De aangekondigde klinische studie vertegenwoordigt een samenwerking tussen het in Californië gevestigde Isis Pharmaceuticals en de Zwitserse farmaceutische reus Roche. Het medicijn, genaamd ASO-HTT-Rx, is een therapie die HD wil behandelen door het gen zelf te targeten.
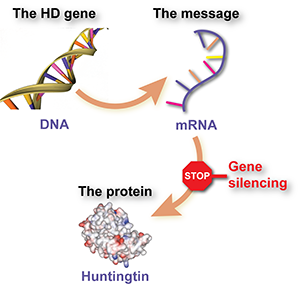
De kern van het probleem bij HD ligt in een defect stuk DNA—een extra lang stuk CAG-bouwstenen binnen het huntingtine gen. De instructies in het mutante gen worden eerst gekopieerd naar een tussenliggende ‘boodschapper’ kopie, waaruit het schadelijke eiwit wordt gemaakt. Dus het mutante gen is de wortel van het probleem, maar het is alleen slecht omdat cellen de informatie in het gen gebruiken om een schadelijk eiwit te maken.
De strategie achter ASO-HTT-Rx is om “de boodschapper neer te schieten”, door de tussenstap tussen gen en eiwit aan te vallen door de vernietiging van de boodschapperkopie te veroorzaken.
Deze soorten medicijnen worden ‘antisense oligonucleotiden’ of ASO’s genoemd. Het zijn synthetische DNA-achtige moleculen die cellen kunnen binnendringen, zich vasthechten aan het mutante huntingtine RNA-bericht, en de afbraak ervan veroorzaken. Als het werkt zoals voorspeld, zal deze therapie voorkomen dat huntingtine eiwit wordt gemaakt—een “huntingtine-verlagende” strategie die op de lange termijn het potentieel heeft om ziekteprogressie te vertragen of te stoppen.
Elke ASO heeft een basisstructuur die kan worden aangepast om het te helpen vasthechten aan het juiste doelbericht, waarbij de duizenden andere berichten in de cel worden genegeerd. Het is een beetje zoals wanneer je naar de ijzerhandel gaat om een sleutel te laten kopiëren—de verkoper selecteert de bijpassende blanco sleutel en graveert dan de juiste reeks groeven om in je slot te passen, maar niet in die van je buren. In het geval van ASO’s gebruiken wetenschappers bij Isis een van hun gevestigde ‘ruggengraat’ moleculen en passen het aan, waardoor het medicijn alleen het Huntingtine-bericht aanvalt.
Dit klinkt allemaal als geavanceerde technologie, maar het goede nieuws is dat Isis eerder ASO-gebaseerde medicijnen in menselijke hersenen heeft getest, in experimentele behandelingen voor ALS (ziekte van Lou Gehrig, of motorneuronziekte) en SMA (spinale musculaire atrofie), en er zijn geen veiligheidsproblemen gerapporteerd.
Medicijntoediening
Een belangrijke manier waarop ASO’s verschillen van conventionele medicijnbehandelingen is dat ze niet oraal als pil kunnen worden ingenomen, maar direct aan het zenuwstelsel moeten worden toegediend.
Om in de hersenen te komen, zal ASO-HTT-Rx worden toegediend via een naald die wordt ingebracht in de met vloeistof gevulde ruimte onder het onderste ruggenmerg. Als dat extreem klinkt, wees gerust dat deze methode routinematig wordt gebruikt in veel gebieden van de geneeskunde. Een vergelijkbare strategie wordt gebruikt door kankerartsen om chemotherapie medicijnen toe te dienen aan patiënten met hersentumoren. Nog vaker ontvangen veel vrouwen vergelijkbare ‘epidurale’ toediening van pijnmedicijnen tijdens de bevalling.
Een groot voordeel van medicijnen zoals ASO-HTT-Rx is dat onderzoekers geloven dat het intermitterend kan worden toegediend en nog steeds effectief is. Wetenschappers hebben deze benadering van intermitterende behandeling bij HD een ‘huntingtine vakantie’ genoemd; met als doel de hersenen een helende pauze te geven van de schade veroorzaakt door het mutante Huntingtine eiwit.
Eenmaal geïnjecteerd in het ruggenmergvocht duurt het ongeveer 4 tot 6 weken voordat ASO-HTT-Rx zijn effect heeft, en uit dierstudies denken we dat de stillegging dan ongeveer 4 maanden zal duren. Op dit moment is de studie ontworpen om patiënten eenmaal per maand de medicijnbehandeling te laten ontvangen.
“Medicijnen vergelijkbaar met ASO-Htt-Rx hebben veilig gezond gedrag hersteld in diermodellen van HD, en het verplaatsen van de behandeling naar mensen is een opwindende stap voor de hele HD-gemeenschap. Hoe opwindend deze wetenschap ook is, de eerste geplande studie is strikt ontworpen om te begrijpen of het medicijn veilig is.”
Veiligheid eerst
De beslissing om door te gaan met een klinische studie die start in 2015 is het resultaat van meer dan tien jaar werk waarbij veel onderzoekers in zowel de academische wereld als de industrie betrokken waren. Wanneer behandeld met ASO-Htt-Rx, tonen laboratoriummuizen die HD modelleren robuuste voordelen—zelfs het behandelen van hen met ASO’s nadat ze symptomen vertonen leidt tot verbeteringen in hun hersenen en gedrag.
Isis onderzoekers en Prof Sarah Tabrizi, University College London en wereldwijd hoofd van de ASO-HTT-Rx studie, benadrukken dat deze eerste klinische studie puur is ontworpen om de veiligheid te evalueren.
Dit is een cruciaal punt. Hoe opwindend deze wetenschap ook is, de eerste geplande studie is strikt ontworpen om te begrijpen of het medicijn veilig is. Het direct injecteren van elk medicijn in het zenuwstelsel kan niet lichtvaardig worden gedaan—alle potentiële risico’s en bijwerkingen moeten uitputtend worden onderzocht bij een klein aantal vrijwillige patiënten.
Anatomie van een klinische studie
Alle Fase I klinische studies hebben allereerst als doel de veiligheid en verdraagbaarheid van nieuwe medicijnen te evalueren. Dit betekent dat een kleine groep patiënten (waarschijnlijk rond de 36) zal worden behandeld met verschillende hoeveelheden ASO-Htt-Rx, om te bepalen of het medicijn nadelige bijwerkingen heeft, en om te helpen de optimale dosis te vinden.
Ongeveer 25% van de betrokken patiënten zal een placebo-injectie ontvangen (een die geen medicijn bevat) om te dienen als vergelijkingsgroep. Artsen zullen de symptomen van patiënten in reactie op de behandeling monitoren, maar de hoofdfocus van deze studie gaat over of het nieuwe medicijn veilig is.
Zodra een medicijn veilig is bevonden in Fase I, kan het doorgaan naar Fase II. Het is bij deze tweede stap dat artsen grotere aantallen patiënten kunnen rekruteren en kunnen beginnen te onderzoeken hoe effectief het medicijn is in het behandelen van ziektesymptomen. Na het vaststellen van veiligheid en dosis in de eerste studie, kunnen onderzoekers nu de vraag stellen: ‘maakt deze behandeling de HD-symptomen van mensen beter (of slechter!)’?
Als de resultaten van de Fase II-studie positief zijn, behelst een Fase III-studie nog grotere aantallen patiënten, waarbij de bijwerkingen, effectiviteit en veiligheid van het medicijn zorgvuldig worden onderzocht. Een succesvolle Fase III-studie is het soort resultaat dat farmaceutische bedrijven nodig hebben om een medicijn goedgekeurd te krijgen door nationale regelgevingsinstanties.
Afbeelding credit: Shutterstock
Wat betekent dit voor HD-patiënten?
Het hele proces van het op de markt brengen van een medicijn duurt jaren, zelfs als alles perfect gaat. Als ASO-Htt-Rx veilig blijkt te zijn in de zojuist aangekondigde Fase I-studie, is dit eerste resultaat slechts het begin van een lange weg in de kliniek. Elke studie langs dat pad, Fasen I, II en III, zal een relatief klein aantal behandelde patiënten betreffen. Bovendien zullen binnen elk van deze studies enkele van de vrijwilligers placebobehandeling ontvangen om te dienen als vergelijking voor patiënten die HTT-ASO-Rx ontvangen.
Patiënten in de Fase I-studie van HTT-ASO-Rx zullen worden gerekruteerd uit slechts een paar medische centra in Europa en Canada. Een kleine set aangewezen HD-onderzoekscentra, die begin 2015 zullen worden aangekondigd, zullen proberen studiedeelnemers te rekruteren. De rekruten zullen mensen zijn in de vroege stadia van HD, maar de specifieke inschrijvingscriteria, locaties en timing zijn nog geen publieke informatie. We weten zeker dat er veel gedetailleerde planning achter de schermen gebeurt, en dat iedereen heel hard werkt om deze studie zo snel mogelijk vooruit te helpen.
Veiligheid, onzekerheid, hoop
Samenvattend zijn we enthousiast dat de eerste menselijke studie van een medicijn dat de grondoorzaak van HD aanpakt al volgend jaar zal starten. Dit enthousiasme wordt getemperd door het besef dat deze eerste studie helemaal over veiligheid gaat, slechts een zeer klein aantal HD-patiënten betreft, en dat veel details van de studie nog onzeker zijn.
Medicijnen vergelijkbaar met ASO-Htt-Rx hebben veilig gezond gedrag hersteld in diermodellen van HD, en het verplaatsen van de behandeling naar mensen is een opwindende stap voor de hele HD-gemeenschap. We zullen de voortgang van de studie met een scherp oog volgen, zodat we hopelijk intermitterende doses van voorzichtig optimisme kunnen bieden.
Meer informatie
- Link naar de website van Isis Pharmaceuticals, ontwikkelaar van de ASO-HTT-Rx therapie
- HDBuzz interviewt Prof Sarah Tabrizi, wereldwijd hoofd van de ASO-HTT-Rx therapeutische studie
- Wetenschappelijke lezing door Prof Sarah Tabrizi op de 2014 European Huntington’s Disease network bijeenkomst waarin de lancering van de ASO-HTT-Rx studie werd aangekondigd
Bronnen & Referenties
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


