
Focus op fibrillen; wetenschappers geven ons een glimp van huntingtin-eiwitklonters
Wetenschappers hebben krachtige microscopen gebruikt om te kijken naar kleverige fragmenten van het Huntington-ziekte-eiwit, wat licht werpt op deze structuren waarvan wordt gedacht dat ze de ziekte veroorzaken

Een groep wetenschappers van de EPFL in Lausanne, Zwitserland heeft een artikel gepubliceerd in het Journal of the American Chemical Society, waarin klonters worden beschreven die bestaan uit een fragment van het huntingtin-eiwit. Een woord dat vaak wordt gebruikt om deze te beschrijven is “aggregaten”. Met behulp van zeer krachtige microscopen kon het team inzoomen en de details van de 3D-structuren van deze monsters nauwkeurig bekijken. De ophoping van huntingtin-eiwitaggregaten wordt beschouwd als een belangrijk kenmerk van de ziekte van Huntington (HD), dat bijdraagt aan de progressie van de ziekte. Maar tot voor kort wisten we heel weinig over hoe ze eruitzagen. Met deze spannende nieuwe glimpen van aggregaten onder de microscoop hopen wetenschappers tools te bouwen om ze te visualiseren in de hersenen van mensen met HD, of zelfs schadelijke aggregaten naar de prullenbak in hersencellen te sturen.
Aggregaten, amyloïden en vezels – wat betekent dit allemaal?
Veel ziekten die de hersenen aantasten, waaronder neurodegeneratieve ziekten zoals Parkinson, Alzheimer en Huntington, worden gekenmerkt door de ophoping van klonters van eiwitdeeltjes in hersencellen. Bij HD is het een klein en kleverig fragment van het huntingtin-eiwit zelf dat deze klonters vormt, die wetenschappers vaak huntingtin-aggregaten noemen.

“Aggregaat” is een chique woord voor wanneer veel kopieën van hetzelfde eiwitdeeltje aan elkaar plakken om veel grotere driedimensionale structuren te maken. Soms zijn deze aggregaten een rommelige puinhoop van veel eiwitdeeltjes allemaal door elkaar heen. Maar andere keren zijn de moleculen veel meer georganiseerd en vormen ze repetitieve structuren. Sommige van deze meer georganiseerde structuren zien eruit als vezels en worden amyloïden of fibrillen genoemd.
Je kunt deze verschillende organisaties van eiwitdeeltjes zien als een toren van Jenga-blokjes. Elk blokje vertegenwoordigt een enkel eiwitdeeltje. Wanneer de blokjes allemaal netjes samen in een toren zijn gestapeld, lijkt dit een beetje op eiwit-amyloïden of fibrillen. Maar wanneer de blokjes uiteindelijk omvallen in een rommelige stapel, lijkt dit meer op wat we denken dat een ongeorganiseerd eiwit-aggregaat eruit zou kunnen zien.
Wetenschappers zijn over het algemeen (en irritant genoeg) liefhebbers van jargon, dus je zult zien dat ze al deze woorden vaak door elkaar gebruiken. Maar voor dit artikel gaan we ons richten op huntingtin-fibrillen; georganiseerde driedimensionale vezels die bestaan uit heel veel kopieën van een klein en kleverig fragment van het huntingtin-eiwit.
Van muizen en mensen… en bacteriën
Aggregatie van het huntingtin-eiwit is een lang gedocumenteerd kenmerk van de ziekte van Huntington. In hersenen van mensen die zijn overleden aan HD kunnen we kleurstoffen en andere handige chemische labels gebruiken om deze aggregaten onder de microscoop te zien in verschillende soorten zenuwcellen. In diermodellen van HD, die genetisch zijn gemanipuleerd om het kleine kleverige fragment van het huntingtin-eiwit te maken, hebben wetenschappers aangetoond dat deze aggregaten zich in de loop van de tijd ophopen. In veel HD-modeldieren zijn de niveaus van aggregaten in verschillende delen van de hersenen geassocieerd met de ernst van HD-achtige symptomen.
“Bacteriën worden door de wetenschappers gemanipuleerd om huntingtin-eiwitfabrieken te zijn, die heel veel kopieën van dit molecuul maken”
Een van de problemen met het bekijken van de aggregaten in de hersenen is dat er veel andere moleculen zijn in de cellen waar we aggregaten vinden, dus we moeten over het algemeen speciale kleurstoffen gebruiken die aan de aggregaten plakken om ze te zien. Deze benadering geeft ons echter niet veel gedetailleerd inzicht in de soorten aggregaten die aanwezig zijn of hun 3D-structuren.
Om dit probleem te overwinnen, kijken wetenschappers naar zeer zuivere monsters van aggregaten die ze synthetisch maken in het lab. Onschadelijke bacteriën worden door de wetenschappers gemanipuleerd om huntingtin-eiwitfabrieken te zijn, die heel veel kopieën van dit molecuul maken. De wetenschappers kunnen dan huntingtin uit de bacteriën vissen en deze monsters gebruiken om fibrillen te maken in een reageerbuis die lijken op die we zien bij mensen. De fibrillen kunnen worden gemaakt met niet-uitgebreid huntingtin-eiwit of uitgebreid huntingtin, overeenkomend met het huntingtin-eiwit met en zonder de HD-mutatie. Dit betekent dat wetenschappers de effecten van de HD-mutatie op de fibrillen kunnen onderzoeken.
Wat kunnen krachtige microscopen onthullen over deze aggregaten?
Na het maken van deze synthetische huntingtin-fibrillmonsters, keek het team van onderzoekers uit Zwitserland ernaar met behulp van een fancy apparaat genaamd een cryogene elektronenmicroscoop. Dit type microscoop stelt je in staat om echt in te zoomen en de fibrillen in veel detail te zien. De fibrillen zijn extreem klein – slechts 3-10 nanometer breed, ongeveer 100.000 keer kleiner dan de dikte van je vingernagels – maar zijn gemakkelijk zichtbaar onder dit type microscoop.
In deze studie maakten de wetenschappers veel foto’s van de fibrillen met de microscoop en gebruikten toen speciale software om vergelijkbare afbeeldingen samen te middelen. Dit middelingsproces verbetert de kwaliteit van de afbeelding, waardoor de kenmerken van de fibrillen gemakkelijker te zien zijn – een beetje zoals het veranderen van het contrast of de helderheid op je telefoonscherm om het display duidelijker te zien.
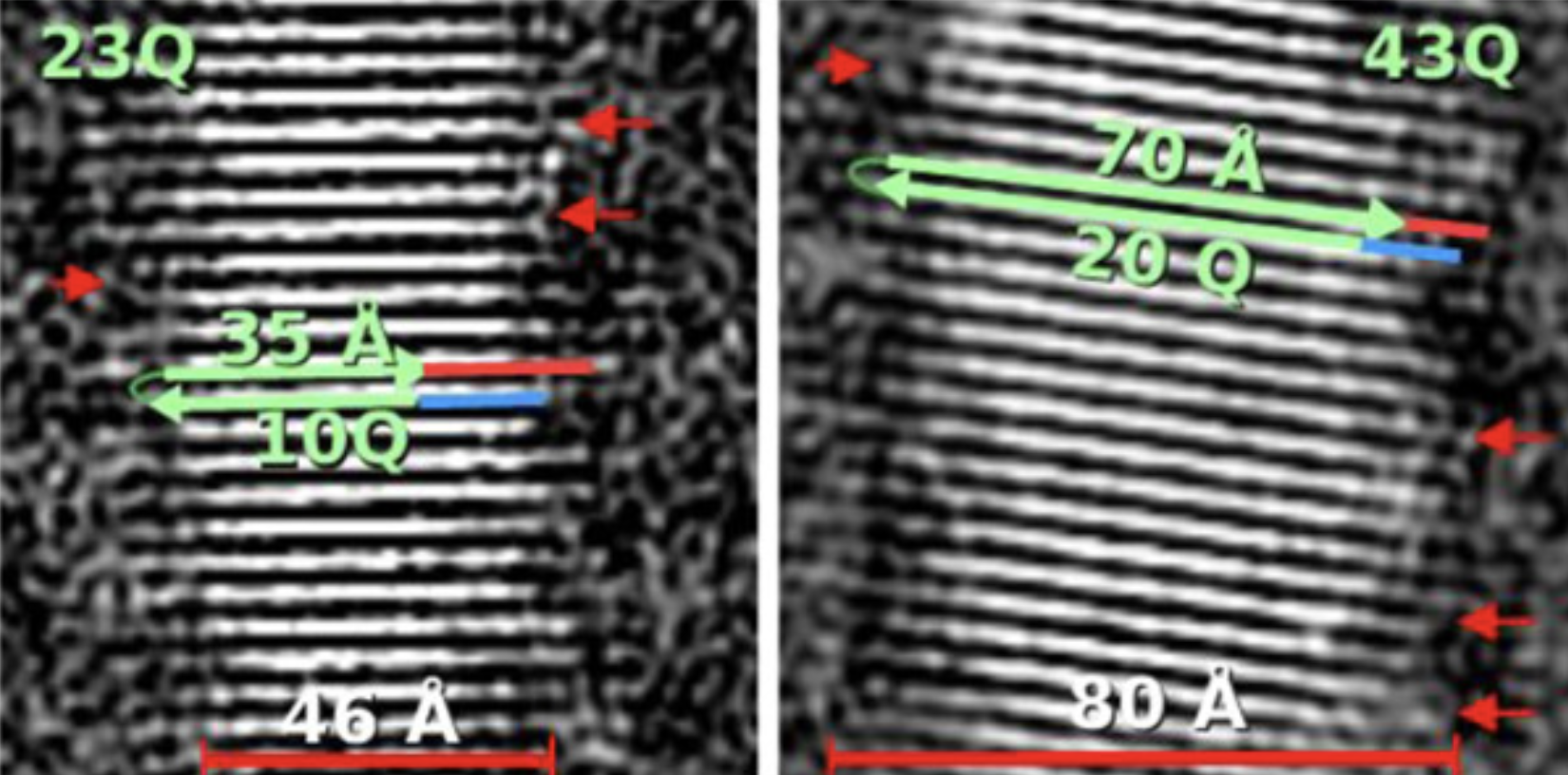
Uit deze afbeeldingen van de fibrillen konden de wetenschappers hun afmetingen meten en uitzoeken hoe alle huntingtin-eiwitdeeltjes waren georganiseerd. Ze konden zien dat ze samen waren gestapeld en uitgelijnd in platte linten, een beetje alsof je veel Jenga-blokjes zou nemen en ze allemaal naast elkaar zou leggen om een dunne, enkele laag blokjes te maken. Veel linten van huntingtin zijn bovenop elkaar gelaagd in de fibrillen, wat zou zijn alsof je steeds meer lagen van uitgelijnde Jenga-blokjes bovenop de eerste zou toevoegen.
Interessant genoeg ontdekten de onderzoekers dat de HD-mutatie leidde tot veranderingen in de afmetingen van de huntingtin-eiwitfibrillen, evenals veranderingen in het aantal linten van huntingtin die bovenop elkaar waren gestapeld. De wetenschappers maakten ook fibrillen van een nog kleiner fragment van het huntingtin-eiwit waarbij een gebied helemaal aan het begin van het molecuul ontbreekt. Ze toonden aan dat deze fibrillen veel meer ongeorganiseerd waren en bestonden uit een mengsel van verschillende organisaties van de huntingtin-eiwitdeeltjes.
Deze bevindingen zijn belangrijk omdat ze aantonen dat de Huntington-ziekte-mutatie en andere regio’s van het huntingtin-gen de 3D-structuur en organisatie van huntingtin-eiwitfibrillen beïnvloeden. Fibrillen die uniform of meer ongeorganiseerd zijn, kunnen de boel op verschillende manieren verstoren, dus dit is belangrijk om te begrijpen.
Hoe zal dit werk mensen helpen die getroffen zijn door de ziekte van Huntington?
Ons diepgaande begrip van de structuur van aggregaten in de Huntington-ziekte-hersenen staat nog enigszins in de kinderschoenen, maar we kunnen kijken naar werk in andere ziektegebieden om te zien welke belofte dit type studie kan hebben (naast het genereren van echt coole afbeeldingen van de fibrillen natuurlijk).
“De Huntington-ziekte-mutatie beïnvloedt de 3D-structuur en organisatie van huntingtin-eiwitfibrillen”
Op het gebied van Alzheimer-onderzoek wordt dit type benadering nu gebruikt om te kijken naar fibrillen uit de hersenen van patiënten die zijn overleden. Dit werk heeft een verbazingwekkend niveau van detail van de fibrillstructuren onthuld, waarbij precies wordt getoond waar elk atoom zich bevindt. Door fibrillen van mensen met verschillende vormen van de ziekte van Alzheimer te vergelijken, konden wetenschappers subtiele verschillen in hun organisatie zien en toonden aan dat er verschillen zijn tussen patiënten, diermodellen van de ziekte van Alzheimer en de synthetische fibrillen die in het lab worden gegenereerd. Voor andere soorten fibrillen die wetenschappers hebben onderzocht, is de variatie van patiënt tot patiënt significant, hoewel het nog niet duidelijk is hoe dit zich verhoudt tot symptomen of ziekte-ernst.
Andere studies tonen aan hoe hersenbeeldvormingsmoleculen genaamd PET-liganden binden aan de fibrillen. Het Huntington-veld heeft een PET-ligand die bindt aan fibrillen (we schreven hier onlangs over op HDBuzz) maar we weten nog niet precies waar het bindt op deze structuren, dus misschien kunnen wetenschappers op een dag deze benadering gebruiken om de PET-ligand beter te begrijpen.
Over het algemeen is het werk van de onderzoekers bij de EPFL een spannende stap voorwaarts terwijl we meer beginnen te begrijpen over huntingtin-fibrillen en heeft het een basis gelegd voor toekomstige studies waarbij we misschien meer informatie kunnen verzamelen over dit belangrijke kenmerk van HD.
Meer informatie
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


