
De donkere kant van DNA-herstel blootleggen om behandelingen voor de Ziekte van Huntington te ontwikkelen
Een gen, beter bekend als MSH3, helpt bij het herstellen van ons DNA maar bij de ZvH kan het uitschieten en extra CAG-herhalingen veroorzaken. Onderzoekers hebben nieuwe inzichten over de werking van MSH3, wat deuren opent naar nieuwe behandelopties.
Een gen, beter bekend als MSH3, zorgt voor de codering van een bepaald eiwit dat een rol speelt bij het herstellen en onderhouden van ons DNA. Dit gen is een spraakmakend onderwerp geworden in het onderzoek naar de ziekte van Huntington (ZvH) sinds meerdere genetische studies veronderstellen dat dit gen een sleutelpositie heeft in de ZvH. Een onderzoeksteam van de Nationale Universiteit van Ierland, Galway, heeft onlangs nieuwe inzichten gepubliceerd over de manier waarop het MSH3-eiwit wordt gecontroleerd in onze cellen. Deze nieuwe inzichten kunnen helpen in het ontwikkelen van medicatie die zich richt op het vertragen of zelfs het voorkomen van de ZvH.
MSH3 – het zwaard dat aan twee kanten snijdt
Het MSH3-eiwitmolecuul corrigeert genetische fouten en het beschermt ons genoom tegen de dagelijkse, continue aanval op ons DNA. Het doet dit door ons DNA te scannen op zoek naar fouten en tegelijkertijd andere eiwitten te werven die kunnen helpen bij het herstellen van ons DNA. Dit proces wordt ‘mismatch-reparatie’ genoemd.

Zoals je misschien weet, wordt de ZvH veroorzaakt door een ongebruikelijke verlenging van herhalende ‘C’-‘A’-‘G’ DNA-basen (de bouwstenen van de genetische code) in het gen genaamd “huntingtine”. In de hersengebieden die zijn aangetast door de ZvH is deze verlenging van herhalende DNA instabiel – daarmee wordt bedoeld dat er CAG-herhalingen kunnen bijkomen gedurende een mensenleven. We noemen dit proces CAG-repeat expansie, of somatische instabiliteit. Voor de meeste ziektes met CAG-repeat expansie geldt: hoe groter de verlenging, hoe erger de symptomen van de ziekte.
Wanneer MSH3 deze CAG-herhaling in ons DNA tegenkomt, herkent MSH3 het als een fout en probeert het te herstellen, maar in plaats van herstellen zorgt MSH3 juist voor meer herhalingen – en maakt het dus allemaal nog erger!
Hoe kunnen we dit voorkomen?
Als we een medicijn kunnen ontwikkelen dat ervoor zorgt dat MSH3 deze fout niet meer maakt, kunnen we het CAG-repeat expansieproces vertragen of voorkomen. Op deze manier hopen we dat het de ziekte vertraagt – of zelfs tot stilstand brengt… Maar hoe kunnen we dit doen zonder de normale functie van MSH3, die zich bezighoudt met beschermen van onze genetische code, te verstoren? Normaal gezien, wanneer er geen DNA-reparatiegenen zijn, kunnen er allerlei problemen ontstaan door de opeenstapeling van DNA-schade – zoals kanker, bijvoorbeeld. In tegenstelling tot andere DNA-reparatie-eiwitten, die een rol spelen in het CAG-repeat expansieproces, lijkt de totale verwijdering van MSH3 niet tot veel negatieve bijwerkingen te leiden. Dit maakt MSH3 zo intrigerend. Het heeft een erg goed reservesysteem intact wanneer het afwezig is – waardoor het een ideaal doelwit is voor medicijnen.
Wat is er dan nieuw?
“Als we een medicijn kunnen maken dat ervoor zorgt dat MSH3 deze fout niet meer maakt, kunnen we het CAG-repeat expansieproces vertragen of voorkomen. Op deze manier hopen we dat het de ziekte vertraagt – of zelfs tot stilstand brengt”
Onze cellen kunnen het MSH3-eiwit langzamer laten doen werken door een uniek, chemisch kenmerk toe te voegen, een zogenoemde acetylgroep. Door deze acetylgroep te verwijderen werkt MSH3 juist sneller. Dat heeft tot gevolg dat er sneller CAG-repeat expansie optreedt en daarom willen onderzoekers het verwijderen van deze acetylgroep voorkomen. Eerdere onderzoeken suggereren dat het eiwit HDAC3 betrokken is bij het verwijderingsproces. Het Laheu-laboratorium van de Nationale Universiteit van Ierland, Galway, heeft een medicijn in menselijke cellen getest die ervoor zorgt dat HDAC3 niet meer goed werkt, en hebben gekeken naar het effect op CAG-repeat expansie .
Wat hebben ze gevonden?
Ze zagen dat het medicijn de CAG-repeat expansie deed stoppen in menselijke cellen. En het allerbelangrijkste, ze zagen dat het geen effect had op andere belangrijke DNA herstelprocessen , wat suggereert dat deze behandeling niet leidt tot een grotere kans op het krijgen van kanker. De onderzoekers hebben dit medicijn ook gebruikt om beter te kunnen begrijpen hoe HDAC3 in verband staat met MSH3. Eiwitmoleculen hebben speciale signalen genaamd ‘Celkern Lokalisatie Sequenties’. Deze functioneren als een soort postcode waarmee eiwitten naar de celkern worden geleid waar ons DNA is opgeslagen. De onderzoekers kwamen er achter dat de acetylgroep de MSH3-postcode verandert waardoor het uit de celkern wordt gezet en het geen CAG-repeat expansie meer kan veroorzaken.
Wat betekent dit allemaal?
Alles bij elkaar genomen, suggereert hun onderzoek een nieuw regulatiemechanisme voor CAG-repeat expansie namelijk het verwijderen van acetylgroepen van het MSH3-eiwit via het HDAC3-eiwit. Dit zou kunnen verklaren waarom patiënten met bepaalde MSH3-varianten een langzamere progressie van de ziekte hebben als het bijvoorbeeld moeilijker is om hun acetylgroep te verwijderen.
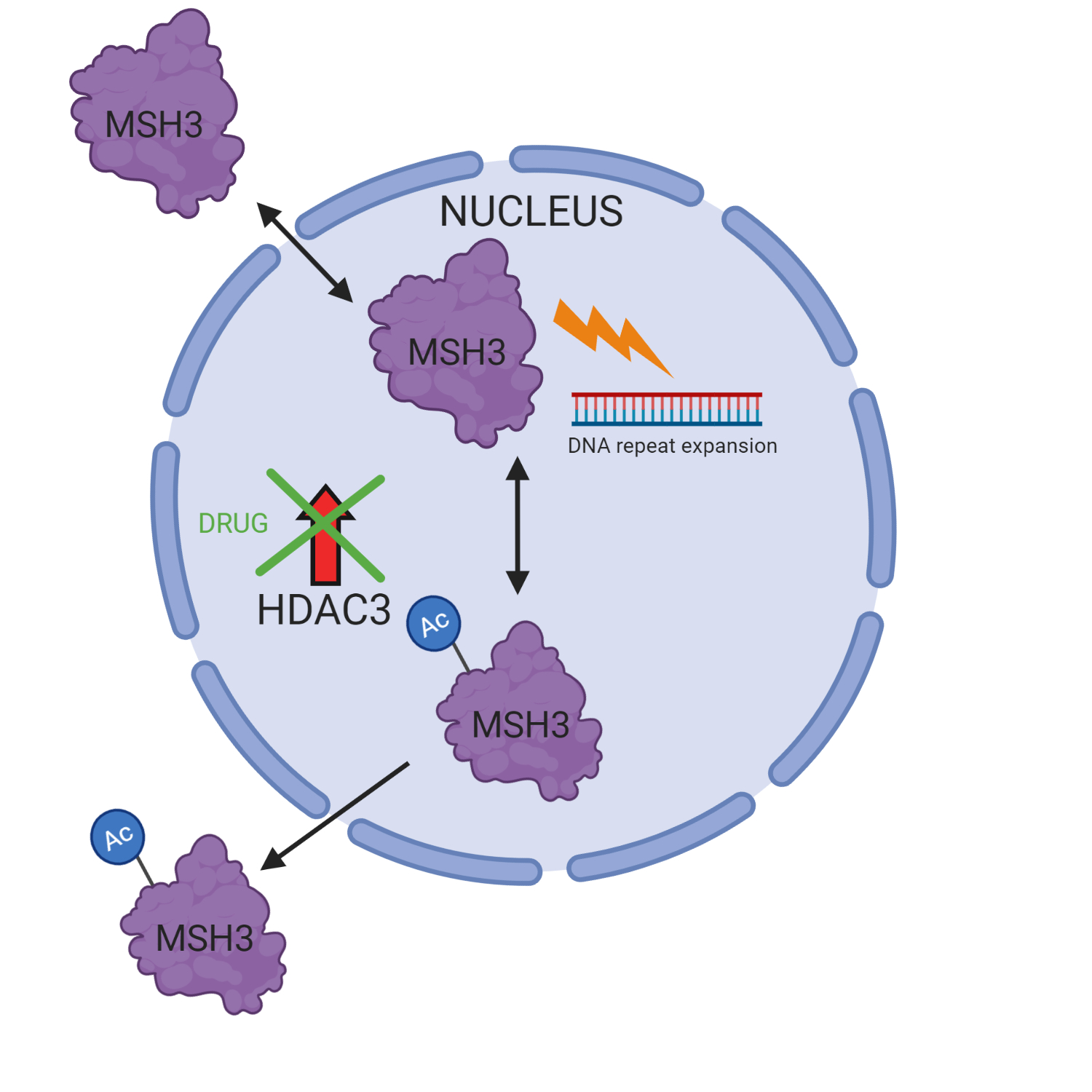
Het begrijpen van ziektemechanismen op deze manier opent deuren voor het ontwerpen van medicijnen met als doel het vertragen van het CAG-repeat expansieproces (en natuurlijk, de ziekte zelf) – met name omdat ze beweren dat het afremmen van het HDAC3 geen invloed heeft op de belangrijkste functie van DNA namelijk de mismatch-reparatie. Het medicijn dat is gebruikt in dit onderzoek is krachtig, selectief en vrij goed bestudeerd. Het is dus misschien van nature al een veelbelovende, klinische kandidaat.
Dit gezegd hebbende, knoeien met HDAC’s kan allerlei andere ongewenste effecten in cellen met zich meebrengen. We moeten zorgen dat medicijnen die het HDAC3-eiwit als doelwit hebben veilig zijn, en met beperkte bijwerkingen. Ook moeten we nadenken over een manier waarop we HDAC3 kunnen afremmen in de dieper gelegen gebieden van de hersenen die worden aangetast door ZvH want dat blijkt tamelijk moeilijk te zijn.
Samengevat: dit onderzoek is veelbelovend, maar er moet nog veel meer onderzoek worden gedaan voordat we echt enthousiast kunnen worden over deze potentiële behandeling.
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


