
De ziekte van Huntington therapeutische conferentie 2020 – Dag 1
HDBuzz brengt het laatste nieuws over de ZvH therapeutische conferentie in Palm Springs


Onze nieuwe schrijvers Rachel Harding en Sarah Hernandez rapporteren vanuit de Huntington’s Disease Therapeutische Conferentie – de grootste jaarlijkse bijeenkomst van ZvH-onderzoekers
Dinsdagmorgen – ZvH genotype en phenotype
Goedemorgen vanuit het zonnige Palm Springs! We zijn verheugd hier te zijn voor de 15e jaarlijkse ZvH Therapeutische Conferentie. Dit jaar worden we, naast Ed en Jeff, vergezeld door de nieuwe schrijvers van HDBuzz – Dr. Rachel Harding (http://twitter.com/LabScribbles) en Dr. Sarah Hernandez (http://twitter.com/rungenado). Joel Stanton (http://twitter.com/JoelEDStanton) compileert onze live twitter-output in onze dagelijkse berichten.

Sessie 1 wordt ’genotype en fenotype‘ genoemd, de wetenschappers onderzoeken hoe de ZvH-mutatie (genotype) impact heeft op de ZvH-symptomen (fenotype). De eerste spreker is Dr. Seth Ament, die het werk van zijn laboratorium beschrijft om de eerste veranderingen in kaart te brengen die plaatsvinden in de hersencellen van muizen met de ZvH-mutatie. De cellen in ons lichaam, inclusief deze in onze hersenen, bevatten DNA dat codeert voor meer dan 20.000 genen. Welke genen in een bepaalde cel worden in- of uitgeschakeld bepalen hoe die cel werkt. Het laboratorium van Ament heeft onderzocht welke genen tot expressie worden gebracht en de wijzigingen die hierin optreden als gevolg van de ziekte. Hij streeft ernaar de specifieke factoren te begrijpen die ervoor zorgen dat ZvH-cellen andere reeksen genen tot expressie brengen.
Eerst beschrijft Dr. Ament zijn werkmethode om de locaties in kaart te brengen waar het huntingtine-eiwit, geproduceerd door het ZvH-gen, zich aan het DNA hecht. De meest voor de hand liggende manier waarop huntingtine impact kan hebben op welke genen worden in- of uitgeschakeld, is door zich rechtstreeks aan het DNA te binden. In feite kleeft het huntingtine-eiwit bij ZvH-muizen aan andere delen van het genoom in vergelijking met gewone muizen. Dit suggereert dat huntingtine rechtstreeks iets doet met het DNA en dat is belangrijk voor het begrijpen van de ZvH.
Bij gemuteerde ZvH-muizen is het huntingtine gehecht aan het DNA op locaties waar veel actie plaatsvindt: genen die worden uitgelezen en gebruikt. Dit suggereert dat mutant huntingtine misschien iets unieks doet in gebieden waar genen actief worden gebruikt. Kan het feit dat huntingtine zich hecht op andere stukken van het DNA verklaren hoe cellen met mutant huntingtine hun cellen enigszins vervormen?
Bij mutante muizen bevatten de gebieden waar huntingtine zich vasthecht ook genen die bij ZvH cellen gewijzigd worden, wat suggereert dat het bovenstaande waar kan zijn. Het team van Dr. Ament vond een verrassende relatie: ze kunnen voorspellen hoe actief of inactief een bepaald DNA-gebied is door te kijken hoe goed het huntingtine-eiwit zich daaraan hecht.
Vervolgens beschrijft Dr. Ament de inspanningen van zijn laboratorium om in kaart te brengen welke genen in ZvH-hersenen zijn veranderd. Verbazingwekkende nieuwe technologieën stellen onderzoekers in staat om genen in individuele cellen in kaart te brengen. Het lab van Ament werkt met deze technieken in het BRAIN-initiatief van NIH. Het laboratorium van Ament gebruikte deze nieuwe technieken om veranderingen in meer dan 13.000 individuele cellen uit ZvH -muizenhersenen te onderzoeken. Er zijn verschillende soorten cellen in de hersenen, en de aanpak van Dr. Ament maakt het mogelijk om veranderingen in elk van die celtypen afzonderlijk in kaart te brengen. Dit geeft een veel duidelijker beeld dan ze gewoon gegroepeerd samen te analyseren. Deze resultaten schetsen de weg naar een veel verfijnder inzicht in wat er precies gebeurt in elk type cel – wat ons zou kunnen helpen begrijpen hoe we elk celtype afzonderlijk moeten behandelen.
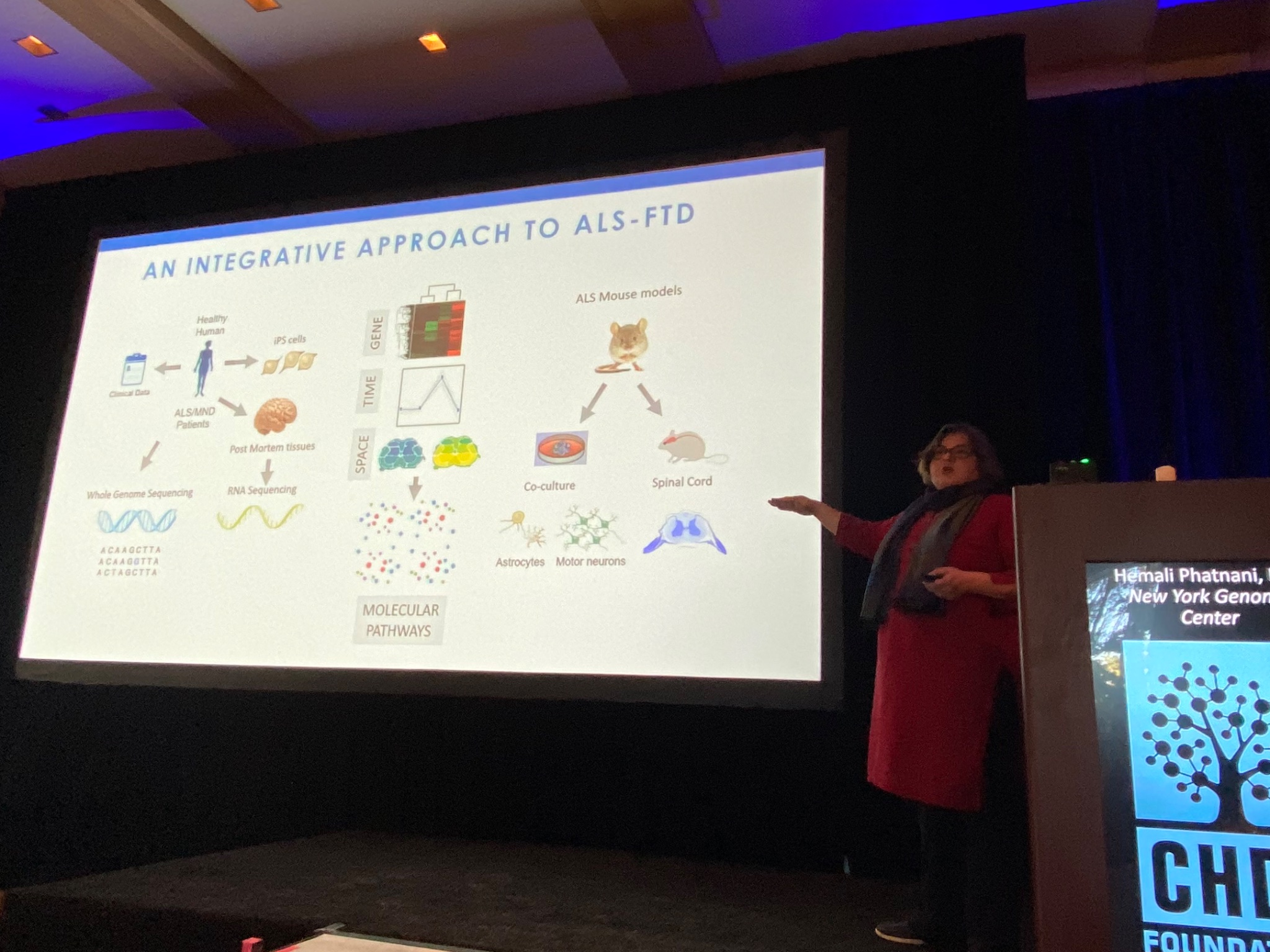
Vervolgens beschrijft Hemali Phatnani van het New York Genome Center, de veranderingen in de hersenen en het ruggenmerg van patiënten met ALS (de ziekte van Lou Gehrig), en van een aanverwante ziekte die FTD wordt genoemd. Phatnani werkt met een grote groep ALS-klinieken om toegang te krijgen tot zeldzame monsters geschonken door ALS-patiënten. Deze worden geanalyseerd en de gegevens worden onmiddellijk beschikbaar gesteld aan onderzoekers over de hele wereld, een geweldig model van open wetenschap! Net als de ZvH is ALS een complexe ziekte; verschillende celtypen in de hersenen ondergaan verschillende veranderingen in de loop van de ziekte. Het team van Phatnani heeft geholpen bij het ontwikkelen van nieuwe methoden om veranderingen in cellen van ALS-hersenen in kaart te brengen. Hun technieken stellen hen in staat om cel-specifieke veranderingen te bestuderen, en hun gegevens zijn beschikbaar voor elke onderzoeker (of nieuwsgierige niet-onderzoeker) om te verkennen op (http://als-st.nygenome.org)
De volgende is Sumanjit Jayadev van het University of Washington Medical Center. Jayadev is geïnteresseerd in het bestuderen van een bepaald type hersencel dat microglia wordt genoemd. Microglia spelen een rol bij de progressie van de ZvH en het wegwerken van microglia in muismodellen kan helpen bij de ZvH-symptomen. Wetenschappers weten al een tijdje dat de ZvH een ontstekingsreactie veroorzaakt en Jayadev is geïnteresseerd in welke hersencellen (behalve neuronen) een rol spelen bij deze ontsteking. Genen die betrokken zijn bij ontstekingen zijn risicofactoren voor de ziekte van Alzheimer (AD: Alzheimer Desease). Jayadev zoekt naar welke cellen in de hersenen deze genen inschakelen om zo het risico op Alzheimer te bepalen. Hij maakt gebruik van een inventieve techniek die gegevens op celniveau leveren. Het onderzoeken van deze veranderingen in afzonderlijke cellen heeft onderzoekers in staat gesteld subtypen van microglia te identificeren, en door het bekijken van deze subtypen identificeerde hij een bepaald type microglia dat alleen aanwezig is in AD. Jayadev werkt aan dit project met de mensen van Sage Bionetworks, experts in open wetenschap en open data in biomedisch onderzoek. Met alle gegenereerde gegevens kan vervolgens de ziekteprogressie van AD worden gevolgd door te kijken welke genen waar en wanneer zijn ingeschakeld. Dit kan helpen bij het definiëren van verschillende populaties van patiënten, waardoor artsen en onderzoekers beter begrijpen hoe het ziekteproces werkt. Als we dit bij de ZvH kunnen toepassen, kunnen artsen misschien in de toekomst door de leeftijd en CAG-lengte van een patiënt te kennen, weloverwogen beslissingen nemen over de behandeling van die specifieke patiënt.
Het volgende onderwerp wordt door William Yang gebracht, een onderzoeker van UCLA die de ZvH bestudeert. Het Yang Lab genereert vele echt grote datasets van verschillende ZvH-muismodellen, waarbij wordt gekeken naar hoe verschillende genen zijn ingeschakeld en welke eiwitten in verschillende celtypen aanwezig zijn. Deze gegevens worden gegroepeerd om de ZvH te vergelijken met controledatasets. In deze big data-sets kunnen wetenschappers zoeken naar patronen en correlaties die kunnen aangeven hoe sommige genen samenwerken in ZvH-muismodellen. Deze patronen kunnen in kaart worden gebracht met behulp van computeralgoritmes om te begrijpen hoe bepaalde celtypen in de hersenen bijdragen aan veranderingen van de genexpressies die werden waargenomen.
Yang concentreert zich op analyseresultaten uitgevoerd met controlemuizen zonder ZvH. Met deze techniek was zijn team in staat belangrijke functies te identificeren alsook de celtypen die bijdragen tot deze functies. Wanneer de reeds in kaart gebrachte patronen van de ZvH-muizen worden gecombineerd met deze van de controlemuizen vinden ze dat genen die de slaap/waak cyclus en de DNA-reparatie regelen, veranderd zijn. Hiermede bevestigen zij wat andere onderzoekers eerder hadden gemeld. Deze kaart kan ook worden gebruikt om andere nieuwe theorieën over de ZvH te testen – een welgekomen hulpmiddel!
Dinsdag namiddag – Somatische instabiliteit.
De middagsessie richt zich op het proces dat ** somatische instabiliteit ** heet. Simpel gezegd treedt somatische instabiliteit op wanneer lange zich herhalende DNA-sequenties in bepaalde celtypen instabiel zijn.
De eerste van deze namiddag is Darren Monckton van de Universiteit van Glasgow. Hij is geïnteresseerd in het bestuderen van de manier waarop somatische instabiliteit de ZvH kan aansturen en hoe het aanpakken van deze instabiliteit een goede strategie kan zijn voor het maken van nieuwe medicijnen voor de ZvH. We weten al een tijdje dat de CAG-lengte kan variëren in weefsels waarbij sommige cellen veel langere lengtes hebben dan andere. Dit is vergelijkbaar met wat we zien bij andere expansieziekten zoals myotone dystrofie. De variatie in de lengte van de CAG-herhaling wordt groter naarmate patiënten ouder worden, wat suggereert dat er dan meer instabiliteit is. Evenzo hoe langer de CAG-herhaling, des te groter de variabiliteit en dus te meer instabiliteit. Het is vermeldenswaard dat dit niet betekent dat uw CAG-getal over het algemeen groter wordt met het ouder worden, dit zal hetzelfde blijven. Het betekent gewoon dat in een paar cellen de lengte van de CAG-herhaling soms kan toenemen.
CAG codeert voor het aminozuur glutamine, daarom wordt de ZvH soms een polyglutamine ziekte genoemd. Maar glutamine kan ook worden gecodeerd door CAA, hoewel het DNA dus anders is, zal het eiwit dat wordt gemaakt hetzelfde zijn als een CAG wordt vervangen door een CAA. Dit gebeurt bijvoorbeeld in het ZvH-gen, waar een lange “C-A-G” -herhaling nog langer wordt in dit soort celtypen. Er is een meer gedetailleerd bericht op HDBuzz hierover, zie (https://nl.hdbuzz.net/271 ).
Een recente interessante bevinding toonde aan dat de aanwezigheid op sommige plaatsen van CAA in plaats van CAG beter is bij het handhaven van een stabiele herhaallengte. De volgende interessante vraag wordt dan, wat drijft de veranderingen die deze somatische instabiliteit veroorzaken? Bewijs wijst niet op DNA-reparatie, een recente hot topic in onderzoek naar de ZvH.
Het identificeren van de specifieke “drivers” (of genen) van deze instabiliteit kan therapeutische implicaties hebben voor de ZvH. Onderzoekers zijn nu op zoek naar welke van deze drivers het belangrijkst zijn bij patiënten, en onderzoeken welke geschikt zijn als doel voor een nieuwe therapie of medicijn. Zo onderzoeken wetenschappers hoe de instabiliteit of veranderingen in de CAG-lengte voor een specifieke patiënt in de loop van de tijd varieert, allemaal dankzij patiënten die met monsters en gegevens hebben bijgedragen aan EnrolHD.
Als we de progressie van de ZvH kunnen volgen door met een eenvoudige bloedtest deze instabiliteit te meten, kunnen artsen op een minder ingrijpende manier de ziekteprogressie van patiënten volgen en de beste manier voorstellen om deze te behandelen.
De volgende is Karen Usdin van de NIH. Zij onderzocht somatische instabiliteit in muismodellen van een ziekte die het zenuwstelsel aantast en die Fragiel X syndroom wordt genoemd. Net als ZvH is fragiele X een expansieziekte, maar in plaats van CAG betreft het hier een CGG-verlenging. We kunnen veel leren van andere expansieziekten, omdat wetenschappers geloven dat er veel overeenkomsten zijn in de oorzaken van deze ziekten. Evenals bij de ZvH worden CGG-herhalingen die Fragiele X veroorzaken, beïnvloed door somatische instabiliteit, en genen die betrokken zijn bij DNA-reparatie beïnvloeden dit proces. Usdin ontdekte, althans in fragiele X-muizen, dat het veranderen van de niveaus van DNA-reparatiegenen, de uitbreiding van de CGG-herhalingen verhindert en zelfs enkele van de herhalingen verwijdert! Het is fantastisch om wetenschappers van buiten het ZvH-domein op deze bijeenkomst te horen over veel interessante ideeën en kennis, die het ZvH-onderzoek sneller vooruit kunnen helpen!
Het laatste onderwerp van deze dag is van Ravi Iyer van het CHDI en gaat over een medicijnontwikkelingsprogramma waar wetenschappers in geïnteresseerd zijn. Een van de doelen van dit programma is het identificeren van kleine moleculen die afkomstig zijn van de CAG-verlenging in de ZvH. CHDI werkt met veel verschillende bedrijven om kleine moleculen te ontdekken met behulp van allerhande verschillende technieken – samenwerking aan deze lastige projecten helpt dingen sneller vooruit te gaan.
Een van de manieren waarop ze kleine moleculen identificeren die mogelijk in aanmerking komen, is door te kijken naar gedetailleerde modellen van de molecuulstructuren waarop ze zich willen richten, zoals eiwitten die betrokken zijn bij DNA-reparatie. Het beste deel van de programma’s die proberen kleine moleculen te identificeren, is dat ze als een pil kunnen worden ingenomen indien wordt aangetoond dat ze effectief zijn tegen de ZvH. Hoewel het vooruitzicht op behandeling met kleine moleculen erg opwindend is, moeten onderzoekers er extra op letten dat de kleine moleculen die ze willen gebruiken geen onverwachte bijwerkingen hebben.
Het maken van kleine moleculen als medicijn voor de ZvH is een boeiend project, maar we zijn nog totaal niet zeker of dit succesvol kan zijn. Een groot team wetenschappers onder leiding van CHDI werkt er hard aan en we kijken uit naar updates in de komende conferenties.
Nu luisteren we naar Brian Battencourt van Triplet Therapeutics, een van de vele bedrijven actief in dit gebied, die ons meer zal vertellen over de therapeutische aanpak van somatische instabiliteit. Een van hun doelen is om de somatische instabiliteit van de CAG-verlenging te stoppen en zo het begin van de ZvH uit te stellen, hopelijk tot een leeftijd zo hoog dat het geen realistische levensduur is! Dit is een zo veelbelovend onderzoeksgebied. Wetenschappers moeten prioriteit geven aan het uitzoeken van moleculen waarmee ze het eerst willen beginnen. Dit stelt hen in staat om zo snel als mogelijk therapieën te ontwikkelen. Na het uitzoeken van veilige kandidaten met een laag risico ontwikkelde de groep van Bettencourt moleculen die zich op acht verschillende genen richten. Hoewel dit een groot aantal doelen is, is het voldoende klein om relatief snel te kunnen werken. Nogmaals, dit onderzoek maakt deel uit van een grotere samenwerking, Bettencourt werkt samen met Jeff Carroll van HDBuzz om deze verschillende potentiële therapeutische doelen te bestuderen. De groep van Bettencourt zou volgend jaar verslag moeten uitbrengen over sommige van deze onderzoeken, dus blijf aandachtig zodat je weet of somatische expansie kan worden gebruikt om de ZvH te behandelen.
De laatste spreker van de dag is onze eigen Jeff Carroll van HDBuzz, die de sessie rond somatische instabiliteit zal afronden. Een van de dingen waarin hij geïnteresseerd is, is het begrijpen van het effect van het verlagen van huntingtine op niet-hersenweefsel zoals de lever. Interessant is dat het verlagen van huntingtine de somatische instabiliteit vermindert in sommige weefsels, maar niet in alle. Het Carroll-lab wilde deze bevindingen beter begrijpen en werkt daarom samen met Sarah Tabrizi om in menselijke hersencellen te kijken. Verlaging van huntingtine in een ander muismodel dat geen ZvH heeft (maar wel ataxie, een andere CAG-herhaalziekte) toont aan dat somatische instabiliteit daar ook daalt, wat misschien suggereert dat het huntingtine-eiwit een algemene rol speelt in somatische instabiliteit. Als huntingtine een rol speelt in de stabiliteit van het genoom, en in hoe goed ons DNA wordt onderhouden, wil het Carroll-lab graag uitzoeken hoe dat kan gebeuren en hoe dit de ZvH-patiënten zou kunnen helpen. Dit is een heel nieuwe waarneming, dus mensen zijn enthousiast om deze bevinding verder te onderzoeken!
En dat is het voor dag 1! Houd ons in de gaten voor onze artikelen over dag 2 en 3 en blijf op de hoogte van wat gezegd wordt op Twitter (https://www.twitter.com/HDBuzzFeed ).
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


