
Het hele genoom screenen voor nieuwe medicijndoelen voor HD
Wetenschappers screenen het HELE genoom om nieuwe potentiële therapeutische doelen voor HD te vinden. Deze ambitieuze studie biedt een schat aan gegevens voor HD-onderzoekers

Een recent gepubliceerde studie in het tijdschrift ‘Neuron’ heeft nieuwe potentiële therapeutische doelen geïdentificeerd voor de behandeling van de ziekte van Huntington (HD). Het werk uitgevoerd door Professor Myriam Heiman en collega’s gebruikte geavanceerde genetische technologieën en ontdekte dat verschillende genen de HD-progressie konden wijzigen in hun modellen in het lab. Veel van deze genen zijn nog niet eerder gekoppeld aan HD en kunnen opwindende nieuwe doelen zijn voor onderzoekers om na te streven bij het ontwikkelen van medicijnen en behandelingen voor de HD-patiëntengemeenschap.
Ambitieuze screening van het hele genoom
Cellen in ons lichaam bevatten DNA dat duizenden genen codeert, elk een recept dat instructies geeft aan onze cellen over hoe ze een ander eiwitmolecuul moeten maken. Deze recepten worden getranscribeerd van ons DNA naar een boodschap genaamd het messenger RNA. Het RNA wordt vervolgens vertaald door cellulaire machinerie naar eiwitmoleculen. Wetenschappers kunnen deze processen in het lab manipuleren om de rol van verschillende genen in ons lichaam te begrijpen.
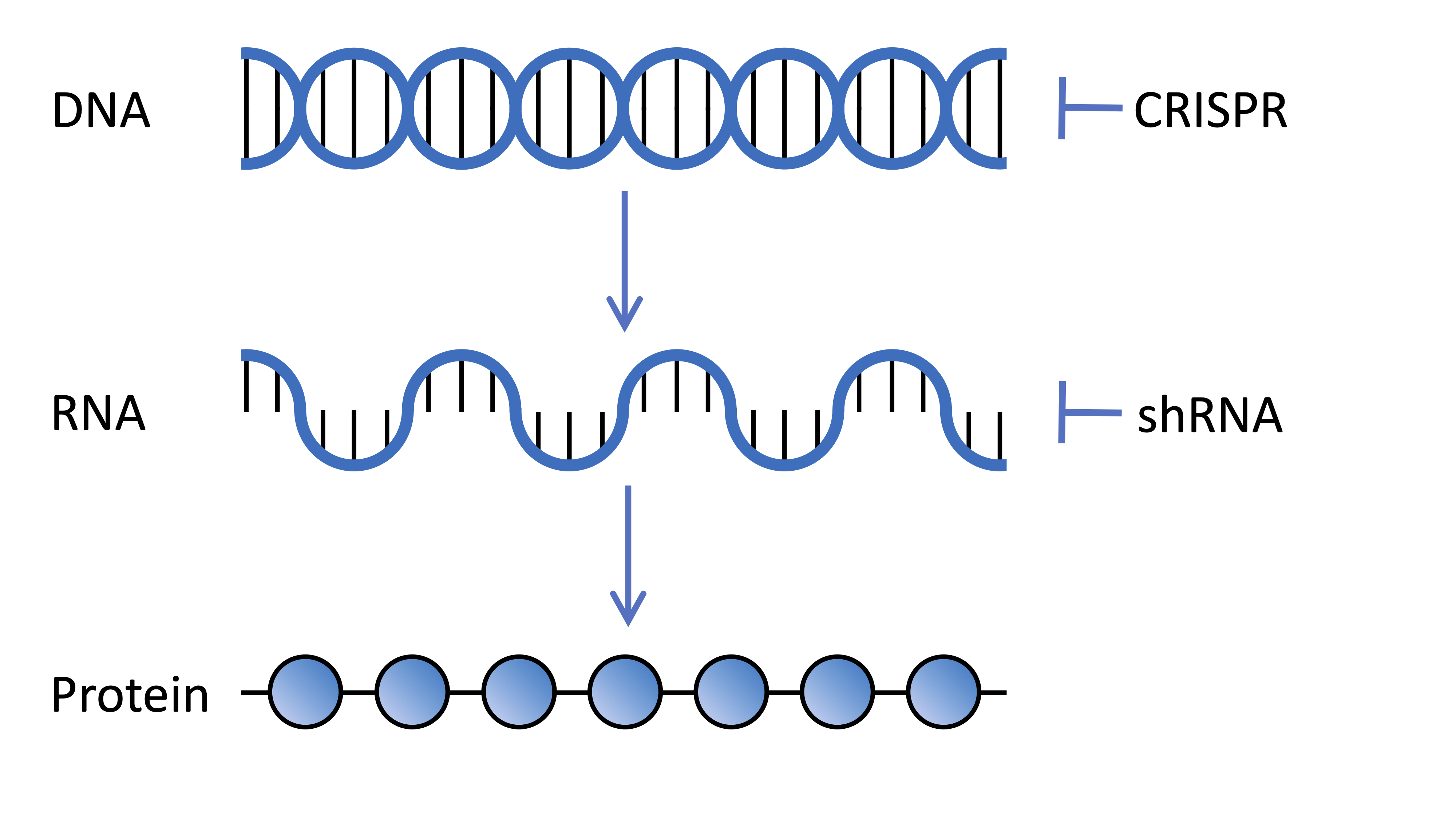
Genetische screens proberen de rol van een enkel gen in verschillende contexten te begrijpen, in dit geval waren de onderzoekers geïnteresseerd in de rol van alle verschillende genen in onze cellen bij het beschermen tegen de schadelijke effecten van de HD-mutatie. Het idee is dus om elk gen afzonderlijk te verstoren, om te proberen te ontdekken of dat gen enige impact heeft op HD-symptomen.
Genetische screentechnologieën kunnen op veel verschillende manieren werken, maar ze hebben allemaal tot doel de expressie van eiwitten van specifieke genen te stoppen of te verlagen. Genen kunnen direct worden gericht door het genoom zelf te bewerken. Andere technologieën interfereren met het boodschapper-RNA dat getranscribeerd wordt van het gen en essentieel is voor de cellen om het eiwit te maken dat het gen codeert.
Dit klinkt misschien bekend voor HDBuzz-lezers omdat dit vergelijkbare technologieën zijn als die gebruikt worden in huntingtin-verlagende therapieën die momenteel beoordeeld worden in verschillende klinische studies. Terwijl deze huntingtin-verlagende therapieën alleen het huntingtin-gen targeten, richten de onderzoekers zich in het geval van deze genetische screen op elk gen in het genoom, één voor één, om uit te zoeken welke rol ze spelen in HD.
Het Broad Institute, waar Prof. Heiman gevestigd is, is wereldleider in het ontwikkelen van bibliotheken die gebruikt kunnen worden voor genetische screens. In deze studie gebruikten de onderzoekers twee verschillende technologieën in hun screen, die beide in hersencellen worden gebracht door speciale soorten virussen. Ten eerste, korte-haarspeld RNA’s die het messenger RNA targeten en de expressie van het gen verlagen door de boodschap te onderbreken zodat deze niet vertaald wordt naar het functionele eiwitmolecuul. Ten tweede werd CRISPR gebruikt om de gensequentie in het genoom direct te bewerken, waardoor het vermogen om ingeschakeld te worden om het eiwit te maken dat het codeert werd verstoord.
Systematische genetische screens in verschillende diermodellen bestaan al tientallen jaren voor eenvoudigere systemen zoals wormen en vliegen. Deze soorten experimenten zijn echter veel technisch uitdagender geweest om uit te voeren voor de hersenen van zoogdieren, wat een belemmering is geweest voor wetenschappers die geïnteresseerd zijn in het uitvoeren van deze screens om verschillende neurodegeneratieve ziekten te begrijpen.
Het team van Prof. Heiman was in staat deze moeilijkheden te overwinnen door een manier te vinden om de reagentia die in de hersenen van de muizen moeten worden geïnjecteerd in de genetische screen te bundelen en te concentreren, en konden het striatum direct targeten, het hersengebied waarin ze geïnteresseerd waren. Het striatum is het zwaarst getroffen hersengebied bij HD-patiënten, daarom werd dit gebied gekozen.
20.000+ genen werden onderzocht in deze ene studie
In plaats van te kijken naar bekende genen geassocieerd met neurodegeneratie in hun muismodellen, namen de wetenschappers in deze studie een onbevooroordeelde benadering en voltooiden een genoomwijde screen om de rol te bekijken die bijna elk gen speelt. In feite screenden ze bijna alle ongeveer 22.000 genen die gevonden worden in muizen! Dit was een ongelooflijk ambitieuze benadering en biedt een schat aan gegevens aan onderzoekers in het HD-veld en daarbuiten.
Omdat dit de eerste systematische screen van alle genen in het centrale zenuwstelsel van zoogdieren was, gebruikten de onderzoekers normale muizen zonder bekende mutaties om uit te zoeken welke genen belangrijk zijn voor hersenceloverleving onder normale omstandigheden. Genen die eerder geïdentificeerd waren in systematische screens in eenvoudigere modellen zoals vliegen en wormen bleken ook belangrijk te zijn in muizen.
In deze studie werden echter veel nieuwe genen geïdentificeerd, waaronder verschillende die een rol spelen in het metabolisme in cellen. Deze waren niet eerder geïdentificeerd in andere systematische screens in vliegen of wormen, wat waarschijnlijk komt omdat het centrale zenuwstelsel van zoogdieren meer energie nodig heeft en meer afhankelijk is van genen die de cellen helpen energie te maken. Deze bevindingen zijn een goede herinnering aan hoe belangrijk het is voor wetenschappers om hun onderzoeksbevindingen te beschouwen in de context van de diermodellen die onderzocht worden.

Naast het controle muismodel werden twee verschillende HD-muismodellen gebruikt in dit experiment, R6/2 en zQ175, die beide uitgebreid beschreven zijn in de HD-onderzoeksliteratuur. Door de genen geïdentificeerd in de screen in de HD-muismodellen te vergelijken met die geïdentificeerd in de controlemuizen, konden wetenschappers uitzoeken welke genen specifiek belangrijk waren voor HD, in plaats van genen die hersencelfunctie meer algemeen beïnvloeden.
Voor de genetische screens uitgevoerd op de twee HD-muismodellen gebruikt in de studie, werden ongeveer 500 genen geïdentificeerd als belangrijk in HD-progressie. Veel van deze genen spelen rollen in pathways die wetenschappers eerder hebben geïdentificeerd in andere studies zoals de genoomwijde associatiestudies (GWAS) die zochten naar genen die de leeftijd van aanvang van HD-symptomen bij menselijke patiënten kunnen veranderen. Deze omvatten genen betrokken bij DNA-schade reparatiepathways die de integriteit van ons genetisch materiaal behouden evenals genen in transcriptiepathways die reguleren hoe het messenger RNA verwerkt wordt in cellen en daarom welke eiwitmoleculen gemaakt worden.
Nieuwe gendoelen werden ook geïdentificeerd in de screen, waaronder genen behorend tot de Nme-familie. Nme-genen zijn eerder gerapporteerd als gekoppeld aan verspreiding in sommige kankers, maar dit is de eerste keer dat ze verbonden zijn met HD. Heiman en collega’s denken dat het targeten van de Nme-pathway belangrijk kan zijn bij het helpen van hersencellen om mutant huntingtin-eiwit in HD-hersenen kwijt te raken. Als we therapeutica kunnen ontwerpen die deze pathway moduleren, zou dit een potentiële manier kunnen zijn om HD te helpen behandelen.
Nieuwe aanknopingspunten voor het maken van nieuwe HD-medicijnen
Zelfs met veel baanbrekende klinische studies gaande die verschillende therapieën voor HD-patiënten testen, is het belangrijk dat onderzoekers blijven zoeken naar alternatieve manieren om potentieel nieuwe medicijnen voor HD te maken. Dit onderzoek biedt een schat aan gegevens over HD zoals het werkt in muismodelhersenen en geeft ons ook ideeën van nieuwe doelen om na te streven als potentiële medicijndoelen, die op een dag in de medicijnontdekkingspijplijn kunnen eindigen. Het zal opwindend zijn om te zien hoe deze nieuwe aanknopingspunten worden opgevolgd door onderzoekers over de hele wereld en ook hoe deze technologie toegepast kan worden op andere neurodegeneratieve ziekten.
Meer informatie
Bronnen & Referenties
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


