Ziekte van Huntington Therapeutische Conferentie 2016 – dag 1
Eiwitten en DNA – Verslag door Jeff en Ed vanop dag 1 van de 2016 #huntingtonsdisease therapeutics conference

Februari, dan komen de meest vooraanstaande wetenschappers wereldwijd samen in Palm Springs voor de jaarlijkse ZvH Therapeutics Conference.
Maandagavond – updates van CHDI Foundation
Voordat de vergadering officieel begint geven medewerkers van de CHDI Foundation updates over de boeiende wetenschap die daar plaats vindt.
Tom Vogt, vice-president Ontdekkingen en Systeembiologie bij het CHDI informeert het publiek over de inspanningen van het CHDI om de ZvH beter te begrijpen. Vogt brengt de dit jaar gepubliceerde grote studie in herinnering over de ontdekking van genen die impact hebben op de beginleeftijd van de ziekte(zie: http://nl.hdbuzz.net/200). Deze genen kunnen ons helpen de ziekte beter te begrijpen, maar kunnen ook nieuwe “doelen” leveren voor medicijnjagers. Om deze doorbraak mogelijk te maken had het onderzoeksteam van letterlijk duizenden patiënten-vrijwilligers DNA stalen nodig.

Een andere grote studie, deze keer op muizen, resulteerde in een enorme hoeveelheid data over hoe de mutatie een impact heeft op verschillende weefsels. Belangrijk is ook dat deze enorme hoeveelheid data wereldwijd online beschikbaar werd gemaakt voor alle wetenschappers. Elke wetenschapper die toegang wenst tot zowel de muisdata als de data van mensen kan deze vinden op https://www.hdinhd.org/
Celia Dominguez, vice-president chemie bij het CHDI geeft de aanwezigen een update over de ontwikkelingsinspanningen voor geneesmiddelen bij het CHDI. Het bestuderen van ZvH-patienten en muismodellen is belangrijk maar uiteindelijk moeten chemici nieuwe medicijnen maken die wij aan mensen kunnen toedienen. Dominguez en zijn team ontwikkelen niet alleen experimentele medicijnen, maar ook andere nieuwe chemische stoffen die ZvH-artsen en wetenschappers in staat stellen hun inspanningen uit te bereiden.
Dominguez en haar team zijn op zoek naar medicijnachtige chemische stoffen die de hoeveelheid gemuteerd ZvH-eiwit, de oorzaak van de ziekte, vermindert. Dominguez geeft het publiek een update over de inspanningen van het CHDI bij het ontwikkelen van medicijnen die cellen helpen de DNA-schade die zich opstapelt tijdens de ZvH, te beperken. Gegevens van muizen suggereren dat ZvH-achtige symptomen kunnen worden onderdrukt door het moduleren van hoe cellen omgaan met DNA-schade. Maar muizen zijn geen mensen en onderzoekers ontwikkelen nieuwe medicijn-achtige chemicaliën in de hoop de bij muizen waargenomen effecten na te bootsen.
Tot slot meldt Dominguez dat chemici werken aan de ontwikkeling van een chemische stof die wetenschappers kunnen waarnemen in de hersenen van patiënten. Een chemisch label waarmee wetenschappers de hoeveelheid schadelijk ZvH-eiwit kunnen meten in de hersenen van levende patiënten! Het team van Dominguez gebruikt dierlijke en menselijke weefselstudies om vast te stellen of deze nieuwe chemische stof doet waarvoor ze ontworpen werd. De eerste resultaten lijken veelbelovend, en evolueren snel naar eerste studies in mensen met de ZvH.
Als dit werkt bij mensen zouden gen-blokkerende klinische testen een krachtig nieuw middel hebben om hun werkzaamheid aan te tonen, zie http://nl.hdbuzz.net/204 . ** Prof Cristina Sampaio ** geeft een uitgebreide update over CHDI’s klinische programma’s waaronder Enroll-HD waardoor een platform voor klinische studies ontstaat. CHDI beoogt “goed onderbouwde” studies te ontwikkelen – d.w.z. met voldoende deelnemers om antwoord te geven op de gestelde vragen. CHDI beoogt ook data beschikbaar te maken zodat de hele Huntington gemeenschap hierover kan beschikken.
Dinsdagmorgen – het huntingtine-eiwit
De 2016 ZvH Therapeutics Conference begint met een sessie over huntingtine, het eiwit gemaakt door het ZvH-gen. ** Professor Elena Cattaneo ** herinnert het publiek er aan dat het ZvH-gen oud is – eerste verschijning meer dan 800 miljoen jaar geleden! Terwijl alleen mensen de ZvH ontwikkelen, vinden we het gen in zee-egels en schimmels. Het is moeilijk om te bestuderen, gedeeltelijk omdat het ongeveer 10 keer groter is dan het gemiddelde menselijk gen.
Cellen gebruiken genen als recepten om “eiwitten” te bouwen die in de cellen functies vervullen. We hebben dus een ZvH-gen, en ook een ZvH-eiwit (huntingtine). Het is waarschijnlijk dat de schade aan de hersenencellen waardoor de ZvH ontstaat een gevolg is van foute werking van het eiwit, niet van het gen zelf.
“Schade aan DNA moet hersteld worden maar het lijkt er op dat dit normale proces verkeerd loopt indien CAG verlenging optreedt in het ZvH-gen”
Deze ochtendsessie focust op een beter begrip van dit oude, grote en belangrijke eiwit. Het eiwit dat de ZvH veroorzaakt beter begrijpen kan ons helpen betere medicijnen te ontwikkelen in de toekomst.
** Ralf Langen **, USC, maakt gebruik van geavanceerde beeldvormende technieken om te trachten een foto te nemen van het ZvH-eiwit. Langen’s team werkt met stukjes gezuiverd huntingtine en kan met de hulp van gesofistikeerde instrumenten afleiden hoe het eiwit gevormd wordt. Eiwitten in cellen doen hun werk dankzij hun unieke vormen. Het werk van Langen is belangrijk om te begrijpen wat het ZvH-eiwit doet. En, misschien het belangrijkste, Langen probeert te begrijpen hoe de structuur van het eiwit wordt veranderd door de ZvH-mutatie. Een eigenaardigheid van het ZvH-eiwit is dat de gemuteerde vorm samenklontert binnen in de cellen. Sommige wetenschappers denken dat deze klontervorming, en niet het individuele eiwit zelf de oorzaak is van de problemen in de hersencellen. Een andere doelstelling in van Langen’s lab is te begrijpen hoe de structuur van een afzonderlijke ZvH-eiwit van vorm verandert als het samenklontert.
** Hilal Lashuel ** is een andere onderzoeker die de vorm van het ZvH-eiwit probeert te doorgronden. In het bijzonder tracht Lashuel te begrijpen hoe de vorm van het ZvH-eiwit reageert op “posttranslationele veranderingen” (!). Na de aanmaak van de eiwitten hechten chemische tags (een label) zich aan het eiwit vast waardoor de vorm van het eiwit wijzigt. Aangezien voor eiwitten geldt dat de vorm de functie bepaalt, zijn deze kleine tags een fijnregeling van de functie van het eiwit in de cel. Waarom maken wij ons zorgen over chemische tags op het ZvH-eiwit. Uit muisstudies weten we dat specifieke tags het ZvH-eiwit minder giftig maakt. Lashuel’s team heeft chemische technieken ontwikkeld om grote hoeveelheden ZvH-eiwit te synthetiseren met naar wens elke specifieke chemische tag aangehecht. Dit stelt de onderzoekers in staat de impact te onderzoeken van allerhande tagcombinaties op de vorm en functie van het ZvH-eiwit.
*Scott Zeitlin, sinds lang ZvH-onderzoeker, tracht het gemuteerde stukje ZvH-eiwit te begrijpen. In plaats van gebruik te maken van reageerbuizen en chemie gebruikt Zeitlin muizen met genen waaruit kleine stukjes verwijderd werden. De eenvoudigste manier om te bestuderen wat een beetje DNA doet is het te verwijderen en dan zien wat er gebeurt. En dit had een verrassend resultaat. Zeitlin stelde vast dat men belangrijke delen van het ZvH-gen kan verwijderen zonder grote impact op de muizen. Zeitin tracht nu te begrijpen of het verwijderen van belangrijke stukjes van het ZvH-gen de ZVH-achtige symptomen in muizen erger maakt.
** Fred Saudou ** van INSERM praat over zijn zoektocht naar wat het ZvH-eiwit eigenlijk doet in cellen want dat is nog steeds een beetje een mysterie. De overheersende theorie is dat de mutatie bijkomende gedragingen of functies creëert die giftig zijn voor de neuronen. Saudoe: Huntingtine is een groot eiwit met spiraalvormige gebieden die met elkaar verbonden zijn en op slinkies lijken (slinky: spiraalvormig speelgoed. De slinky is vooral bekend geworden doordat hij van trappen ‘af kan lopen’, doordat de zwaartekracht de spiraal de trap af laat gaan. …). Welbekend is dat huntingtine assisteert bij het verplaatsen van chemicaliën in de cellen. Zo helpt Huntingtine bij het verplaatsen van een chemische stof, BDNF, van het oppervlak van de hersenen naar de dieper liggende structuren. BDNF is nodig om de cellen in het striatum gezond te houden, maar de ZvH veroorzaakt een vermindering van BDNF-leveringen, en cellen in het striatum sterven. Saudou: Het falen van de BDNF levering kan veroorzaakt worden omdat het gemuteerde eiwit geen energie kan leveren aan de moleculaire motoren van de cellen. Saudou gebruikt een eiwit-knippend enzym, geleend van een virus, om te zien wat er gebeurt als het huntingtine wordt doorgesneden op verschillende plaatsen. Verrassend, maar Saudou vond dat niet één, maar twee sneden nodig waren om het gemuteerde huntingtine-eiwit giftig te maken voor cellen.
Dit is interessant – voorheen dachten we dat juist 1 snede, op de juiste plaats uitgevoerd door een cellulair knip-enzym, volstond. Saudou stelde vast dat het staarteinde van het eiwit – de ‘C terminus’ belangrijker was dan vroeger gedacht. Het lijkt erop dat bepaalde fragmenten van de C-terminus zelf giftig zijn, zelfs van de niet gemuteerde vorm. Interessant! Maar niet-gemuteerd eiwit is niet giftig, dus er is interactie tussen het C-eindpunt en het stukje dat door de mutatie veranderd wordt. Saudou vond dat het C-uiteinde van huntingtine interfereert met een ander eiwit, Dynamin 1, dat belangrijk is voor het transport. Saudou’s inspanning om het hele eiwit en de stukken die geknipt worden te bestuderen wordt voortgezet.
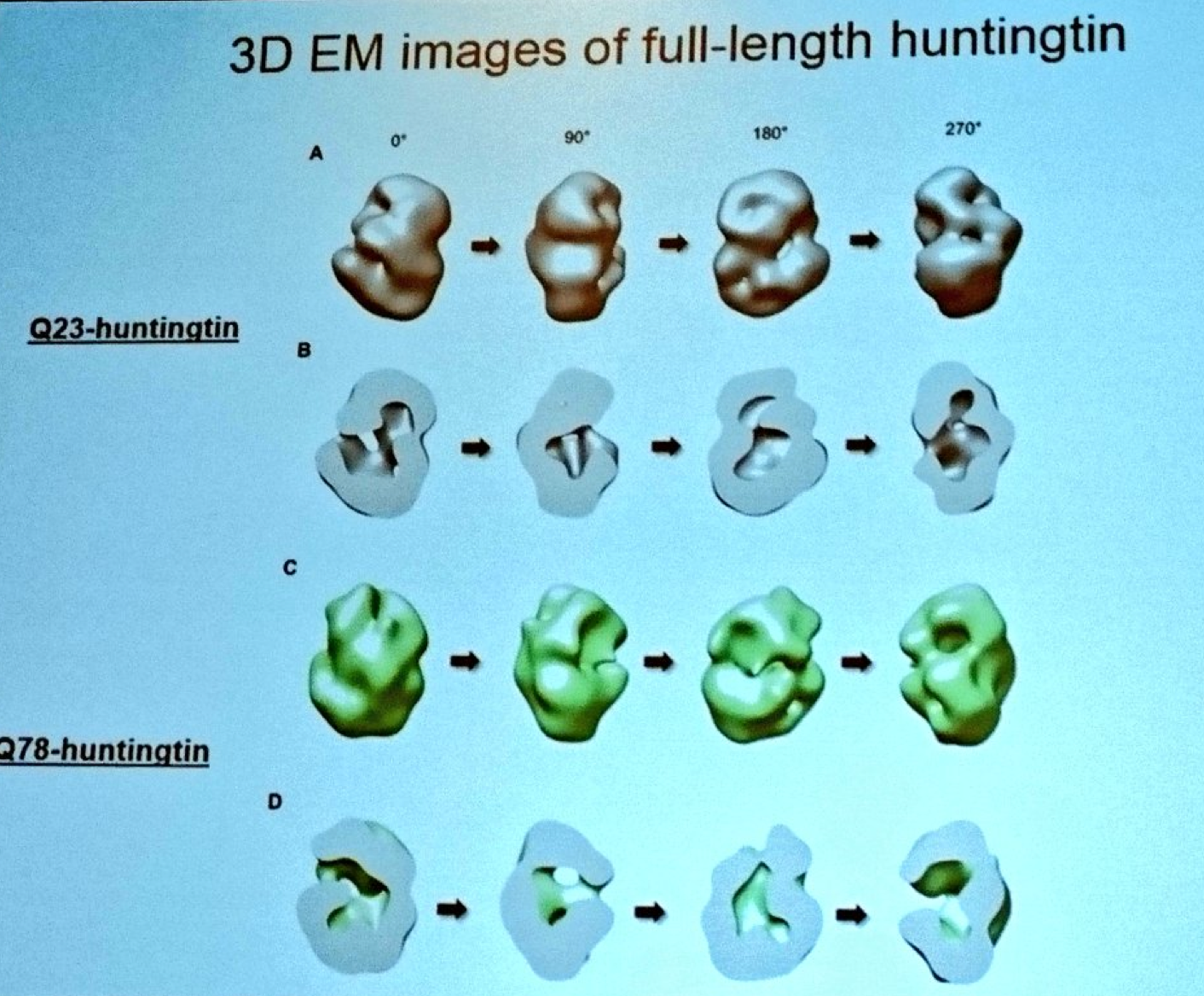
Vervolgens horen we Ihn Sik Seong van het Massachusetts General Hospital. Seong heeft een techniek ontwikkeld om het volledige huntingtine-eiwit te zuiveren zodat hij de structuur ervan kan bestuderen. Met behulp van een superkrachtige elektronenmicroscoop heeft Seong een model ontwikkeld waarmee hij de vorm van het huntingtine kan beschrijven. Omdat hij zowel het normale als gemuteerde huntingtine kan maken, kan Seong zien hoe de algehele vorm van het proteïne wordt veranderd door de mutatie. Het model van Seong suggereert dat huntingtine zich op zichzelf opvouwt, en een holle vorm aanneemt zoals een tennisbal. Om het geheel af te ronden tracht Seong te begrijpen hoe chemische tagging (post-translatie modificatie) het huntingtine-eiwit wijzigt.
Geweldige sessie! Al deze fundamentele wetenschap over hoe de ZvH-mutatie een impact heeft op de huntingtinestructuur en de basis vormt voor de volgende generatie ontdekkingen.
Dinsdagnamiddag – DNA en RNA
Wij blijven deze namiddag bij de fundamentele wetenschap maar maken de overstap van het eiwit naar het DNA. Blijf opletten!
** Steve Horvath **, UCLA, is geïnteresseerd in de chemische veranderingen in DNA als gevolg van het verouderingsproces. Horvath heeft aangetoond dat een van deze chemische veranderingen zo reproduceerbaar is dat het kan worden gebruikt als klok om de leeftijd van een cel te voorspellen. Met behulp van deze genetische klok stelde Horvath vast dat verschillende lichaamsdelen tegen verschillende snelheden ‘verouderen’. Dus: hoe staat het met monsters van de hersenen van mensen met hersenziekten, zoals de ZvH? Verouderen de hersenen van ZvH patienten sneller dan van mensen zonder ZvH? Ja – Gebruik makend van zijn nieuwe genetische klokmethode vond Horvath dat ZvH-hersenen er ouder uitzien dan men zou verwachten.
** Karine Merienne ** bestudeert een proces dat “transcriptie” wordt genoemd, het proces dat bepaalt welke genen door een cel worden geactiveerd. Elke cel in ons lichaam heeft een kopij van de ongeveer 25.000 genen die wij allen van onze ouders hebben geërfd. Hersencellen maken gebruik van hersengenen en huidcellen van huidgenen. “Transcriptie” is het proces waarbij de juiste genen worden ingeschakeld. Het activeringspatroon van het gen is anders in de hersenen van ZvH-patiënten en Merienne gebruikt ZvH-muizen om trachten te begrijpen waarom. Merienne heeft gevonden dat een specifiek proces lijkt verkeerd te gaan in de ZvH-cellen, en dit kan sommige van de veranderingen in de transcriptie helpen verklaren. Een experimenteel medicijn dat dit specifieke transcriptieproces verbetert lijkt de geheugenprestaties van ZvH-muizen te beschermen.
Vanessa Wheeler bestudeert hoe de ZvH-mutatie verergert in specifieke weefsels tijdens het ouder worden. Elke persoon met de ZvH erfde een specifieke wijziging in het DNA, een uitbreiding van de “CAG” DNA-sequentie in het ZvH-gen. Bij ZvH-patiënten is de CAG-herhaling altijd langer dan normaal – meer dan 36 keer. In het algemeen wordt een langere herhaling van het CAG geassocieerd met ZvH symptomen op een vroegere leeftijd, al is er veel variatie tussen mensen onderling. Het lab van Wheeler is geïnteresseerd in een eigenaardig fenomeen – in sommige lichaamsweefsels neigt de CAG-herhaling te verlengen als iemand ouder wordt. Het striatum, het deel van de hersenen dat het meest beïnvloed wordt door de ZvH, is het lichaamsdeel waar CAG-expansie het meest voorkomt.
Wheeler tracht te begrijpen waarom de CAG herhalingslengte in bepaalde lichaamsdelen de neiging heeft toe te nemen tijdens het verouderen. Wheeler’s team heeft vastgesteld dat een proces dat men DNA-herstel noemt aan de basis ligt van dit fenomeen. Schade aan het DNA moet hersteld worden, maar klaarblijkelijk verloopt dit normale proces fout bij de verlengde CAG’s van het ZvH-gen. Een recente studie bij ZvH-patiënten suggereert dat veranderde reactie van de cel op DNA-schade een verklaring zou kunnen zijn voor de variaties in de beginleeftijd van de ziekte. Wheeler voert veelomvattende experimenten uit met nieuwe muizen die zij zelf heeft ontwikkeld om dit “CAG-verlengingsproces“ beter te begrijpen.
Vervolgens komt ** Laura Ranum ** van de Universiteit van Florida praten over een nieuw en controversieel idee. Denk aan het woord CART. Als men je vraagt de 3 startletters te lezen bekomt men CAR. Maar als je bij de 2de letter begint bekom je ART. Iets dergelijks kan gebeuren wanneer cellen DNA lezen. Meestal start het aflezen bij het begin, maar af en toe is er een verschuiving en wordt het DNA “uit sequentie” afgelezen waardoor onverwachte RNA-berichten of zelfs eiwitten ontstaan. Soms wordt DNA achterwaarts afgelezen waarbij vreemde ‘verborgen’ RNA berichten of eiwitten ontstaan. Ranum ontdekte dit eigenaardig DNA-afleesmechanisme en noemde het * RAN transcriptie * (toevallig klinkt het als het begin van haar naam!).
Wij weten dat bij de ZvH , het in de normale richting aflezen van het DNA aanleiding geeft tot de productie van het gemuteerde huntingtine eiwit waarvan we weten dat het schadelijk is voor de neuronen. De vraag is of mutant huntingtine het enige giftige product is van het verlengde gen of dat RAN-transcriptie mogelijk ander giftig RNA of andere schadelijke eiwitten produceert als gevolg van deze eigenaardige DNA-aflezing. Ranum’s team onderzocht hersenstalen van overleden patiënten en vond sommige van deze eigenaardige eiwitten in sommige gebieden. Deze RAN-eiwitten zijn een begin, maar dat wil niet noodzakelijk zeggen dat ze schadelijk zijn. Ranum heeft aangetoond in cellen die in het lab gekweekt werden dat sommige eiwitten schadelijk kunnen zijn, hoewel dat niet noodzakelijk ook zo hoeft te zijn in het hele brein.
Ray Truant (Mcmaster University) tracht de normale werking van het huntingtine-eiwit te begrijpen, en hoe de ZvH-mutatie dit verandert. Net als veel van de sprekers van vanmorgen is Truant vooral geïnteresseerd in kleine chemische tags die het huntingtine-eiwit versieren. Truant gebruikt robotmicroscopen en geavanceerde software om automatisch het effect van medicijnen op ZvH-cellen analyseren. Met deze technieken volgt Truant’s lab het huntingtine-eiwit in de cellen die aan verschillende soorten stress onderworpen worden. Truant heeft ontdekt dat een chemische stof, kinetine er toe bijdraagt gemuteerde ZvH-cellen gezond te houden.
Wanneer ZvH-muizen met kinetine behandeld worden verbeteren sommige ZvH-achtige symptomen, waarbij het idee ontstaat dat deze molecule hieraan zou bijdragen. Truant’s lab voerde ook uitgebreide experimenten uit die aangaven dat huntingtine zou kunnen betrokken zijn bij DNA-schade. Zijn hypothese is dat kinetine het gemuteerde huntintine-eiwit helpt beter te reageren op DNA-schade. Truant koppelt terug naar andere sprekers vandaag, en stelt dat het huntingtine-eiwit mogelijk een rol speelt bij DNA-schade. Truant stelt voor kinetine te bestuderen als potentiële therapie tegen de ZvH.
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…