Dubbel succes voor huntingtine RNAi-genonderdrukking
2 stukjes goed nieuws voor RNAi-genonderdrukking bij ZvH: het is veilig gedurende zes maanden, en er is een manier om grotere hersengebieden te behandelen

De meeste ZvH-onderzoekers zijn behoorlijk enthousiast over het idee om het Huntington-gen te ‘onderdrukken’, om de productie van het schadelijke huntingtine-eiwit te verminderen. Twee uitdagingen – veiligheid en toediening – zijn nu dichter bij een oplossing dankzij samenwerking tussen academische en industriële onderzoekers.
We zijn grote fans van genonderdrukking. Net als veel onderzoekers van de ziekte van Huntington denken we dat dit de aanpak is die het meest waarschijnlijk een effectieve behandeling voor ZvH zal opleveren.
Genonderdrukking houdt in dat een speciaal ontworpen medicijn wordt gebruikt om een boodschappermolecuul, RNA genaamd, te onderscheppen. Dit RNA wordt geproduceerd door het ZvH-gen en vertelt cellen om het schadelijke huntingtine-eiwit te maken. Het effect van het medicijn is dat cellen minder van het eiwit aanmaken.
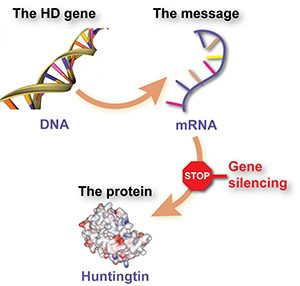
Nog eenvoudiger gezegd, genonderdrukking is als een stopbord voor mutant huntingtine.
Snelle vooruitgang
Tot nu toe heeft genonderdrukking voor ZvH, in verschillende vormen, elke hindernis die het tegenkwam overwonnen. Het is nu getest in verschillende muis- en ratmodellen van ZvH, en heeft niet alleen de progressie vertraagd, maar zelfs verbetering opgeleverd in zowel symptomen als hersenschade. Het lijkt erop dat de hersenen daadwerkelijk kunnen herstellen – tot op zekere hoogte – als de niveaus van het schadelijke eiwit maar een beetje kunnen worden verlaagd.
De resterende hindernissen
Verschillende onderzoeksteams zijn op weg naar menselijke proeven met genonderdrukking bij ZvH. Maar er zijn nog een paar resterende uitdagingen die moeten worden aangepakt voordat dat kan gebeuren.
De eerste is veiligheid. Onverwachte bijwerkingen zijn altijd mogelijk, en kunnen dramatisch zijn, aangezien we het hebben over medicijnen die direct in het zenuwstelsel worden geïnjecteerd of geïnfundeerd, en direct interacteren met de genetische machinerie van onze cellen.
Een andere is toediening. Genonderdrukkende medicijnen kunnen niet als pillen of injecties in het bloed worden gegeven, omdat ze dan niet in de hersenen zouden komen. Dus moeten ze direct in het zenuwstelsel worden ingebracht. Afhankelijk van de structuur van het medicijn betekent dit een operatie om naalden of buisjes in de ruggengraat of de schedel in te brengen. Klinkt drastisch, maar als de behandeling effectief is, zal het de moeite waard zijn.
Het toedieningsprobleem stopt daar echter niet, want zodra het medicijn in het hoofd is, moet het in onze hersencellen komen om zijn genetische toverkunst te kunnen uitvoeren.
Het genonderdrukkingsmenu
Onderzoekers van genonderdrukking moeten verschillende keuzes maken voordat ze aan een behandelingsproef beginnen. Hier is een checklist om je te helpen toekomstige nieuwsberichten te begrijpen.
Ten eerste moeten we beslissen over de structuur van het medicijn. De twee basiskeuzes zijn RNAi-medicijnen, die chemisch vergelijkbaar zijn met de RNA-boodschapmoleculen van het lichaam; en ASO-medicijnen, die iets anders zijn maar mogelijk beter worden opgenomen door cellen.
De tweede keuze is welk doel te kiezen: beide kopieën van het ZvH-gen, of alleen de gemuteerde. Het richten op beide – niet-specifieke onderdrukking genoemd – is gemakkelijker, maar het uitschakelen van het ‘normale’ gen kan gevaarlijk zijn. Alleen het gemuteerde gen aanpakken – allel-specifieke onderdrukking genoemd – is mogelijk veiliger maar veel moeilijker te doen.
De derde keuze is bestemming – waar zal het medicijn naartoe gaan? RNAi-medicijnen verspreiden zich van nature niet ver, dus het medicijn moet direct in de hersenstof worden toegediend. Medicijnen die zich verder verspreiden, zoals ASO’s, kunnen in het vocht rond de hersenen worden geïnfundeerd of, als we geluk hebben, aan de basis van de ruggengraat.
Ten vierde moeten we beslissen over toediening. Wordt het medicijn op zichzelf gegeven, verpakt in een virus of onder druk gepompt, om de verspreiding door de hersenen te vergroten?
De vijfde keuze is behandelingsregime. Moeten we een eenmalige behandeling geven of het medicijn gedurende weken of maanden infunderen? Op dit moment weten we niet hoe lang de effecten zullen aanhouden, dus dit moet worden uitgewerkt door verschillende regimes te vergelijken.
Wanneer je over genonderdrukkingsonderzoek leest, is het handig om van tevoren uit te zoeken welke optie is gekozen voor elk van deze keuzes.
Er komen er ineens drie tegelijk
Tijdens het recente ZvH Wereldcongres in Melbourne rapporteerde HDBuzz over spannende presentaties van verschillende genonderdrukkingsonderzoeksgroepen. In november brachten we je nieuws over de eerste veiligheidsproef van huntingtine-genonderdrukking met RNAi in een primatenbrein.
“Het RNAi-medicijn verspreidde zich verder dan je zou krijgen met eenvoudige injecties. Veel verder zelfs.”
Nu zijn er twee verdere wetenschappelijke artikelen gepubliceerd – elk het resultaat van samenwerking tussen academische onderzoekers en biotechnologiebedrijven. Beide artikelen betroffen het in Minneapolis gevestigde bedrijf Medtronic en het team van Dr. Zheming Zhang aan de Universiteit van Kentucky.
Zes maanden veiligheid
Het novemberrapport over RNAi-veiligheid bij primaten was een vrij korte studie – zes weken. De nieuwe studie door Medtronic en Zhang’s team, gerapporteerd in het tijdschrift Brain, werd ook uitgevoerd bij resusapen, maar duurde een volle zes maanden.
Laten we eens kijken naar wat de onderzoekers bestudeerden, aan de hand van de checklist hierboven:
-
Structuur: dit was een proef met een RNAi-medicijn.
-
Doel: beide kopieën van het gen werden gericht – niet-specifieke onderdrukking.
-
Bestemming: de hersenstof – het striatum, om precies te zijn, dat vroeg wordt aangetast bij ZvH-patiënten.
-
Toediening: het medicijn werd verpakt in een leeg virus, genaamd AAV2.
-
Behandelingsregime: een eenmalige injectie op vijf plaatsen aan elke kant van de hersenen
Het is ook vermeldenswaard dat ‘normale’ apen werden gebruikt, zonder uitgebreide kopieën van het ZvH-gen. Dus deze proef kon alleen eiwitveranderingen en veiligheid meten – het kan geen verbetering bij patiënten voorspellen.
Na de behandeling werden de apen zes maanden geobserveerd, waarbij werd gekeken naar hun algemene gezondheid en bewegingscontrole. De operatie werd goed verdragen, en er werden geen nieuwe problemen waargenomen bij de behandelde dieren.
Zoals gehoopt, daalden de niveaus van het huntingtine-eiwit aanzienlijk in de behandelde gebieden. Bij elke injectieplaats waren de eiwitniveaus verminderd over een gebied van ongeveer zes millimeter in doorsnede – in volume is dat ongeveer drie M&M’s per hersenen. Het klinkt misschien niet als veel, maar in een menselijk brein zou dat een groot verschil kunnen maken, en vergeet niet dat deze metingen 6 maanden na de eenmalige behandeling werden gedaan.
Gelukkig veroorzaakte het medicijn geen schadelijke hersenveranderingen zoals ontsteking, infectie of neuronschade.
Dus het medicijn deed zijn werk om de eiwitniveaus te verlagen, en de behandeling leek geen schadelijke effecten te produceren. De auteurs schatten dat zes apenmaanden gelijk staat aan ongeveer 18 menselijke maanden. Klinkt goed – maar zoals de auteurs opmerken, zou het bij mensen nog langer kunnen duren voordat goede of slechte effecten zich openbaren.
Een innovatieve toedieningsmethode
Het andere nieuwe artikel kwam voort uit een driewegsamenwerking tussen het team van de Universiteit van Kentucky, Medtronic, en RNAi-medicijnbedrijf Alnylam Pharmaceuticals. Het werd gepubliceerd in het tijdschrift Experimental Neurology.
Dit was ook een studie van niet-specifieke onderdrukking met RNAi, toegediend in het striatum van apen.
Wat dit werk onderscheidt, is de innovatieve toedieningsmethode. Er werd een techniek gebruikt die convectie-verbeterde toediening (CED) wordt genoemd. Hierbij worden buisjes door de schedel en in de hersenstof geplaatst. Het bovenste uiteinde van het buisje is verbonden met een kleine pomp die het medicijn voortdurend onder druk door het buisje spuit. Deze druk is de sleutel – het zorgt ervoor dat de medicijnmolecuul zich veel verder verspreidt dan anders het geval zou zijn.

CED wordt al gebruikt om chemotherapiemedicijnen verder te laten verspreiden in hersentumoren. Maar zou het werken om een RNAi-medicijn toe te dienen?
Eerst werd het medicijn zeven dagen lang in de hersenen gepompt. Slechts één kant van de hersenen werd behandeld, zodat de andere kant kon worden gebruikt ter vergelijking. Er werd een reeks doses en infusiesnelheden gebruikt om de beste combinatie te vinden. Daarna werd een infusie van 28 dagen geprobeerd. Slim genoeg maakte het team onschadelijke radioactieve aanpassingen aan het medicijn, waardoor ze precies konden meten hoe ver het zich had verspreid.
Het medicijn deed zijn werk om de huntingtine-niveaus te verlagen, en de buisjes en infusies beschadigden de hersenen niet bijzonder.
Maar was de extra moeite van het aanbrengen van buisjes en pompen de moeite waard – verspreidde het medicijn zich verder? Kortom, ja.
Metingen toonden aan dat het RNAi-medicijn veel verder reikte dan je zou verwachten met eenvoudige injecties. Als beide kanten van de hersenen waren behandeld, zouden de huntingtine-niveaus zijn verlaagd in ongeveer elf M&M’s-volume aan hersenen.
In een notendop…
Voordat deze twee artikelen uitkwamen, wisten we al dat huntingtine kon worden verlaagd in de apenbrein met behulp van RNAi. Nu kunnen we twee grote vinkjes zetten op onze wensenlijst: ten eerste werkt onderdrukking en is het veilig over langere perioden, en ten tweede zijn er manieren om het medicijn verder te laten verspreiden.
Wat zou er mis kunnen gaan?
Voorzichtig optimisme is hier een verstandige benadering. Er zijn zeker dingen die mis zouden kunnen gaan op weg naar menselijke proeven, of tijdens deze proeven.
Deze primatenproeven hebben aangetoond dat het verlagen van huntingtine-niveaus veilig is bij gezonde apen. Maar dat betekent niet dat het zeker veilig is bij menselijke patiënten. Menselijke hersenen zijn veel groter en complexer dan apenhersenen. Dus de behandeling zou minder effectief of gevaarlijker kunnen zijn, simpelweg vanwege het soortverschil.
Het is ook mogelijk dat het gezonde eiwit de hersenen op de een of andere manier beschermt tegen zijn schadelijke broer bij mensen. Als dat het geval is, zou het onderdrukken van beide kopieën onverwacht meer kwaad dan goed kunnen doen.
De hersenen van mensen met ZvH-symptomen zijn waarschijnlijk ook kwetsbaarder en moeilijker te opereren. De delen van de hersenen die behandeld moeten worden, zijn kleiner dan normaal, vanwege de krimp veroorzaakt door ZvH. Dus de operaties kunnen moeilijker en riskanter zijn.
Ten slotte kan het moeilijk zijn om succes bij mensen vast te stellen, omdat de ziekte langzaam vordert en we de hersenen van patiënten niet onder de microscoop kunnen onderzoeken.
Maar vergeet niet – aan al deze problemen wordt gezamenlijk gewerkt door enkele van de beste wetenschappelijke geesten ter wereld, die zich allemaal richten op het realiseren van effectieve behandelingen voor patiënten.
2012 – het jaar van gene silencing voor de ziekte van Huntington?
Zou 2012 het jaar van gene silencing kunnen worden voor patiënten met de ziekte van Huntington? Zullen we in de komende maanden een of meer klinische studies bij mensen zien? Op basis van de vooruitgang tot nu toe, denken we dat dit een redelijke hoop is, en verschillende groepen werken hard om dit werkelijkheid te maken. De eerste studies zullen klein zijn en zullen langzaam en zeer voorzichtig worden uitgevoerd, omdat veiligheid de hoogste prioriteit heeft. Maar als alles goed gaat, zullen er grotere studies volgen.
Meer informatie
- Brain-artikel over 6 maanden RNAi-behandeling door Grondin en collega’s (vrij toegankelijk)
- Experimental Neurology-artikel over convectie-verbeterde toediening van RNAi door Stiles en collega’s (volledig artikel vereist betaling of abonnement)
- Ons artikel over de eerdere veiligheidsstudie bij primaten door Dr. Beverly Davidson
Bronnen & Referenties
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…