
Huntington-ziekte therapeutica conferentie 2018 – dag 3
Updates van dag 3 van de Huntington-ziekte Therapeutica Conferentie: huntingtine proteïne – en het verlagen ervan

Goedemorgen vanaf de laatste dag van de 2018 HD Therapeutica Conferentie! Twee sessies vandaag, de eerste gericht op het proteïne gemaakt van het HD-gen. De tweede bevat updates over Huntingtine Verlagende Trials van zowel Wave Life Sciences als Ionis Pharmaceuticals.
Donderdagochtend – huntingtine proteïne
Elke HD-patiënt heeft dezelfde mutatie geërfd – een verlenging van de sequentie C-A-G. Deze uitbreiding vindt plaats in een gen dat we nu het HD-gen noemen. Genen worden door cellen gebruikt als instructies om proteïnen te maken – de eerste sessie vandaag richt zich op het HD-proteïne.

Sandrine Humbert, Universite Grenoble Alpes, heeft al lang interesse in de ontwikkeling van het brein, en hoe het HD-gen en proteïne dit proces beïnvloeden. Om dit proces te begrijpen, maakte Humbert’s lab een muis die het HD-gen en proteïne miste in hun hersenen. Ze ontdekten dat cellen zonder het HD-gen zich op een abnormale manier deelden en bewogen. Tijdens de hersenontwikkeling kruipen nieuw geboren cellen naar hun juiste locatie, vaak klimmend langs ’touwen’ gevormd door andere cellen. Dit proces is veranderd wanneer het HD-gen wordt weggenomen, wat belangrijke rollen voor het HD-gen in dit proces suggereert.
Andrea Caricasole, IRBM Science Park, voert een grootschalige studie uit naar “post-translationele modificaties” van het Huntingtine proteïne. Dit verwijst naar kleine chemische “versieringen” van het Huntingtine proteïne. Deze versieringen stellen cellen in staat om de functie van proteïnen aan te passen. Het Huntingtine proteïne heeft bijvoorbeeld waarschijnlijk tientallen van deze labels die worden toegevoegd en weggenomen, waardoor de functie van Huntingtine wordt aangepast in reactie op een breed scala aan signalen. Veel van deze versieringen doen intrigerende dingen met het Huntingtine proteïne, en kunnen zelfs voorkomen dat mutant huntingtine proteïne cellen beschadigt. We hebben hier eerder over geschreven op HDBuzz. Caricasole’s team ontwikkelt zeer gevoelige tests voor individuele Huntingtine proteïne versieringen. Deze stellen hen in staat om te volgen welke van deze veranderen tijdens de ziekte, en misschien manieren te zoeken om ze te repareren.
Rohit Pappu, Washington University, hanteert een zeer gerichte benadering voor het begrijpen van het Huntingtine proteïne. Zijn lab ontwikkelt hulpmiddelen om het deel van het proteïne te bestuderen waarvan de vorm wordt beïnvloed door de HD-mutatie. Pappu’s lab gebruikt enorme hoeveelheden rekenkracht om te proberen de vorm te voorspellen van het deel van het huntingtine proteïne dat veranderd wordt door de mutatie. Deze technieken stellen hen in staat om een “kikkervorm” waar te nemen. De vorm van deze kikker is een onderwerp van intens debat geweest in het HD-veld! Pappu’s technieken ondersteunen sterk één kant van dit debat, wat ons zeker zal helpen dit kritieke deel van het huntingtine proteïne beter te begrijpen
Xiao-Jiang Li van Emory University heeft een interessant muismodel ontwikkeld waarbij het huntingtine gen kan worden uitgeschakeld bij volwassen muizen, in het brein, lichaam of beide. Deze muizen hebben geen uitgebreide huntingtine genen – ze helpen ons gewoon te begrijpen of het uitschakelen van de ‘gezonde’ versie van het gen gevolgen heeft. Geruststellend is dat wanneer het gen wordt uitgeschakeld, er niets ergs gebeurt in het brein. Onverwacht veroorzaakte het uitschakelen van het gen ontsteking van de alvleesklier. Het is onduidelijk wat dat zou kunnen betekenen voor patiënten, maar huidige huntingtine verlagende behandelingen worden niet verwacht huntingtine niveaus in het lichaam significant te verlagen – alleen in het brein. Li heeft ook CRISPR-Cas9 genoom editing gebruikt om het schadelijke stukje van het HD-gen in muizen weg te knippen. Het deactiveren van het mutante gen bij muizen verminderde succesvol de vorming van het giftige huntingtine proteïne en de muizen bewogen ook beter. Dr Li is erg druk geweest! Hij heeft ook een Huntington-ziekte model varken gemaakt met CRISPR genoom editing. Zou nuttig kunnen zijn voor het testen van nieuwe medicijnen omdat varkenshersenen vergelijkbaar zijn met die van mensen.
“Kochanek bevroor het proteïne en gebruikte een elektronenstraal om er duizenden foto’s van te maken. Die werden vervolgens door een computer gecombineerd om de allereerste beelden te produceren van de gedetailleerde moleculaire structuur van het huntingtine proteïne.”
Ankur Jain van @UCSanDiego bestudeert RNA – de “boodschappermoleculen” die ontstaan wanneer een cel de instructies in DNA wil gebruiken om een proteïne te maken. Ons DNA leeft in de kern van onze cellen, maar RNA drijft vrij rond door de hele cel. De traditionele manier van denken over veel genetische hersenziekten is dat ze worden veroorzaakt door giftige proteïnen, maar er is steeds meer bewijs dat soms de RNA boodschappermoleculen geproduceerd door mutante genen ook giftig kunnen zijn. Bijvoorbeeld, sommige RNA sequenties kunnen vastplakken aan belangrijke proteïnemachines en voorkomen dat ze hun werk in de cel doen. Een mogelijk teken van giftig RNA is de vorming van abnormale klodders RNA die in cellen worden gezien bij HD en andere hersenziekten. Jain heeft ontdekt dat hij kunstmatige klodders RNA kan vormen door het te verwarmen en af te koelen zoals gelei. Deze klodders vormen zich alleen wanneer het RNA plakkerige sequenties bevat zoals die van de CAG stretch bij HD. Het is niet duidelijk of deze RNA klodders schade veroorzaken bij HD, maar dat zouden ze kunnen doen. Bijvoorbeeld, als het RNA vastzit in de kern, kan het niet worden gebruikt om proteïnen te genereren. Antisense moleculen (vergelijkbaar met die momenteel in HD menselijke trials) kunnen vastplakken aan het RNA in de kern en voorkomen dat ze klodders vormen. Andere medicijnen zouden theoretisch ook kunnen worden gebruikt om het RNA plakkerigheidsprobleem bij hersenziekten aan te pakken.
Spannende last-minute lezing nu van Stefan Kochanek, wiens lab zojuist de structuur van het huntingtine proteïne heeft ontdekt! Uitzoeken hoe proteïnen eruit zien is een echt belangrijke stap in het begrijpen hoe ze werken en hoe dat met medicijnen te veranderen. Het huntingtine gen werd 25 jaar geleden ontdekt maar het proteïne is groot, wiebelig en plakkerig wat het echt moeilijk heeft gemaakt om zijn structuur te ontdekken. Eén team stuurde het proteïne zelfs de ruimte in om te proberen kristallen te laten vormen, maar helaas, geen succes. Kochanek’s team is geslaagd waar anderen hebben gefaald en hun resultaten werden zojuist gepubliceerd in Nature. De grote doorbraak was het stabiliseren van huntingtine met behulp van een ander proteïne genaamd HAP40 (“huntingtine-geassocieerd proteïne 40”). Eenmaal gestabiliseerd met HAP40, bevroor Kochanek het proteïne en gebruikte een elektronenstraal om er duizenden foto’s van te maken. Die werden vervolgens door een computer gecombineerd om de allereerste beelden te produceren van de gedetailleerde moleculaire structuur van het huntingtine proteïne. Dit is serieus cool en geeft ons een hoop om aan te werken. Eén voorbehoud echter: sommige gebieden waren nog steeds te wiebelig om de structuur uit te vogelen – inclusief het allerbelangrijkste stukje aan het begin van het proteïne dat de mutatie bevat.
Donderdagmiddag – huntingtine verlaging
Groot einde van de dag en de conferentie als de sessie over Huntingtine Verlagende therapieën begint. Huntingtine verlaging verwijst naar benaderingen die gericht zijn op het verlagen van de niveaus van het Huntingtine proteïne. Er zijn veel manieren om dit te doen, maar veel van hen richten zich op het “RNA” dat een tussenstap is tussen de informatie in het HD-gen en het Huntingtine proteïne.
Michael Rape, UC Berkeley, is geïnteresseerd in het verleiden van cellen om individuele proteïnen in een cel te vernietigen. In veel gevallen, inclusief HD, zou het echt nuttig zijn om selectief één specifiek proteïne te verwijderen. Cellen hebben meer dan één proteïne afbraakroute – een belangrijke gebruikt een kleine chemische versiering genaamd “ubiquitine” als label. Cellen herkennen ubiquitine als een soort “eet mij” signaal en breken proteïnen af die ze dragen. Rape’s lab is betrokken geweest bij het begrijpen hoe cellen ubiquitine labels gebruiken om proteïnen te labelen die heel snel vernietigd moeten worden – eentje die giftig zou kunnen zijn, bijvoorbeeld. Rape’s lab heeft hulpmiddelen gebouwd die onderzoekers, voor het eerst, laten kijken naar proteïnen die door dit snelle vernietigingsproces gaan. De machinerie voor snelle proteïne vernietiging is een krachtig hulpmiddel – eentje waar Rape’s lab geïnteresseerd is in het benutten. Een recent ontwikkelde techniek – genaamd “PROTAC” – stelt onderzoekers in staat om het ubiquitine systeem te benutten om cellen ertoe te brengen specifieke proteïnen te vernietigen.
Scott Zeitlin (University of Virginia) werkt met HD-muizen om te proberen uit te vogelen wat er gebeurt wanneer we mutant huntingtine, normaal huntingtine of beide verlagen. Houd in gedachten dat elke persoon één huntingtine erft van elke ouder – en de meeste mensen met HD hebben één normale en één mutante kopie. Wetenschappers noemen het gezonde / normale proteïne “wild-type” omdat het degene is die gebruikelijker is in het wild. Deze vragen zijn belangrijk omdat alle huntingtine-verlagende therapieën erop gericht zijn de totale hoeveelheid huntingtine proteïne in het brein te verminderen. Sommige, zoals Ionis’s medicijn, verminderen beide versies van het proteïne gelijk. Anderen, zoals Wave’s medicijnen, proberen het mutante meer te verlagen dan het wildtype proteïne. We denken dat het waarschijnlijk is dat het verlagen van mutant proteïne op zichzelf of parallel aan het wild-type proteïne gunstig zal zijn – maar het is nog steeds een open vraag of het verlagen van huntingtine veilig is. Zeitlin heeft muizen gefokt waarbij de productie van het mutante, wild-type of beide proteïnen kan worden verminderd nadat de muis volledig is opgegroeid. Zeitlin vond dat het vroeg verlagen van mutant huntingtine een groter effect had wat betreft de ophoping van het proteïne in het brein. Evenzo had vroege vermindering van mutant huntingtine grotere voordelen voor gewichtsverlies en bewegingsvaardigheid bij de muizen. Hetzelfde gold voor het verminderen van de productie van beide versies van het proteïne – vroege behandeling had grotere voordelen. Conclusie: vroeger is beter als het gaat om het onderdrukken van huntingtine. Bij één test (gripkracht) verbeterde het verlagen van alleen het mutante proteïne de prestaties, maar het onderdrukken van beide versies niet. Verder waren beide benaderingen ongeveer even effectief en de sleutelfactor was hoe vroeg de behandeling werd gegeven. Zeitlin keek ook naar wat er gebeurt als je huntingtine laat terugkeren, en dit was slecht voor de muizen. Dat suggereert dat langdurige behandeling beter is dan kortdurende – precies wat je zou verwachten.
Jodi McBride, OHSU, beschrijft haar werk met het gebruik van onschadelijke virussen om instructies te leveren aan hersencellen die hen helpen hun eigen RNA-vernietigende moleculen te maken. Een van de voordelen van dit soort benadering is dat de virussen de RNA-vernietigende moleculen voor altijd laten maken, in theorie een eenmalige behandeling mogelijk maken. McBride bestudeert haar behandeling door deze te leveren aan apen, die grote complexe hersenen hebben die veel meer op de onze lijken. Specifiek werkt haar team aan het leveren van het virus aan een deel van het brein genaamd het “putamen”. Het putamen is bijzonder interessant, omdat het een van de meest kwetsbare hersengebieden bij HD is – het ondergaat veel krimp bij mensen die de HD-mutatie erven. McBride beschrijft verbeteringen in de hersenoperatie die vereist is voor het leveren van de virussen, inclusief het gebruik van MRI om het brein te beelden terwijl injecties plaatsvinden. De virale behandeling leidde tot verminderingen van het HD-gen RNA met ongeveer de helft door het gehele putamen, een opmerkelijke verbetering ten opzichte van eerdere pogingen. Volgende – Mike Panzara van Wave Life Sciences, die 2 trials plannen met “Antisense Oligonucleotiden” (ASO’s) voor HD. ASO’s zijn korte, gemodificeerde stukjes DNA die cellen binnendringen en een doelwit RNA vernietigen, waardoor de niveaus van het doelwit proteïne verminderen
Panzara vertelt de menigte dat Wave momenteel twee trials van ASO’s bij HD-patiënten uitvoert. Waarom twee? Wave’s benadering is gebaseerd op het richten op kleine genetische variaties – genaamd SNP’s, of “snips” – in het HD-gen. Deze kleine variaties veroorzaken geen HD, ze zijn gewoon onderdeel van de normale genetische variatie tussen mensen – de reden waarom we niet allemaal identieke tweelingen zijn. Interessant is dat deze varianten alleen worden gevonden op een van de 2 kopieën van het HD-gen die elke persoon heeft. Door deze varianten te richten, kunnen Wave’s ASO’s onderscheid maken tussen de mutante en niet-mutante kopieën van het HD-gen. Wave voert momenteel vroege-fase veiligheidsstudies uit van 2 ASO’s in studies genaamd PRECISION-HD1 en PRECISION-HD2. De ASO’s gebruikt in deze studies richten zich op verschillende genetische variaties in het HD-gen. De truc bij deze benadering is dat mensen niet alleen de HD-mutatie moeten hebben geërfd, maar ook begeleidende varianten die het mogelijk maken dat de mutante kopie van het gen uniek gericht kan worden. Deze trials zijn dus noodzakelijkerwijs gericht op patiënten die deze variaties dragen. Wave heeft echt coole nieuwe technologieën ontwikkeld om deze varianten te detecteren, en te bepalen welke op de mutante kopie van het HD-gen zitten, niet op de normale kopie. Wave voerde een voorlopige studie uit waarin ze doelwitten voor hun ASO’s konden vinden bij 64% van de vrijwilligers
“Spontaan applaus terwijl Tabrizi de moedige vrijwilligers in de eerste studie bedankt, hen “echte onderzoekshelden” noemend.”
Volgende zijn Anne Smith van Ionis en Sarah Tabrizi van UCL die de resultaten presenteren van een trial ontworpen om ASO’s te testen die gericht zijn op beide kopieën van het HD-gen. Dit is het hoogtepunt van vele jaren werk – Smith herinnert het publiek eraan dat het Ionis programma in 2005 begon! Ze begonnen met cel- en dierstudies, die vroeg bewijs leverden dat ASO-behandelingen Huntingtine proteïne verminderen, en HD-achtige symptomen beter maken. In 2012 en 2013 werden resultaten van HD muismodel studies gepubliceerd die aantoonden dat huntingtine verlaging HD-achtige symptomen verbeterde. Smith schetst de logica die @ionispharma gebruikte om de beslissing te nemen ASO’s te gebruiken die gericht zijn op beide kopieën van het HD-gen, in plaats van alleen de mutante kopie. Een voordeel van ASO’s is dat ze zich wijd verspreiden door het brein. Smith toont gegevens van apenexperimenten die aantonen dat na injectie in het ruggenmergvocht, ASO’s zich zeer wijd verspreiden door het brein. Ionis bestudeerde ook de verspreiding van nog grotere dieren, zoals varkens, en vond dat het medicijn zich zeer wijd verspreidde. Toxiciteitsstudies werden vervolgens uitgevoerd, wat suggereert dat langdurige toediening van het medicijn zeer goed werd verdragen (tot 15 maanden in apenstudies). Het is bijna onmogelijk om hersenweefsel te bemonsteren van patiënten behandeld met ASO’s – dus hoe weten we of de ASO zijn werk deed? Smith beschrijft apenstudies die een relatie vaststelden tussen huntingtine verlaging in het brein en verlaging van het ruggenmergvocht. Dit stelde Ionis in staat om een zeer ingewikkeld computerprogramma te bouwen om te voorspellen hoeveel Huntingtine verlaging er plaatsvindt in het brein en het ruggenmergvocht, dat gemakkelijk toegankelijk is via een lumbaalpunctie. Op dit punt werd Ionis vergezeld door een grote farmaceutische partner, Roche, die de middelen en ervaring hebben om ingewikkelde menselijke trials voor ASO’s uit te voeren.
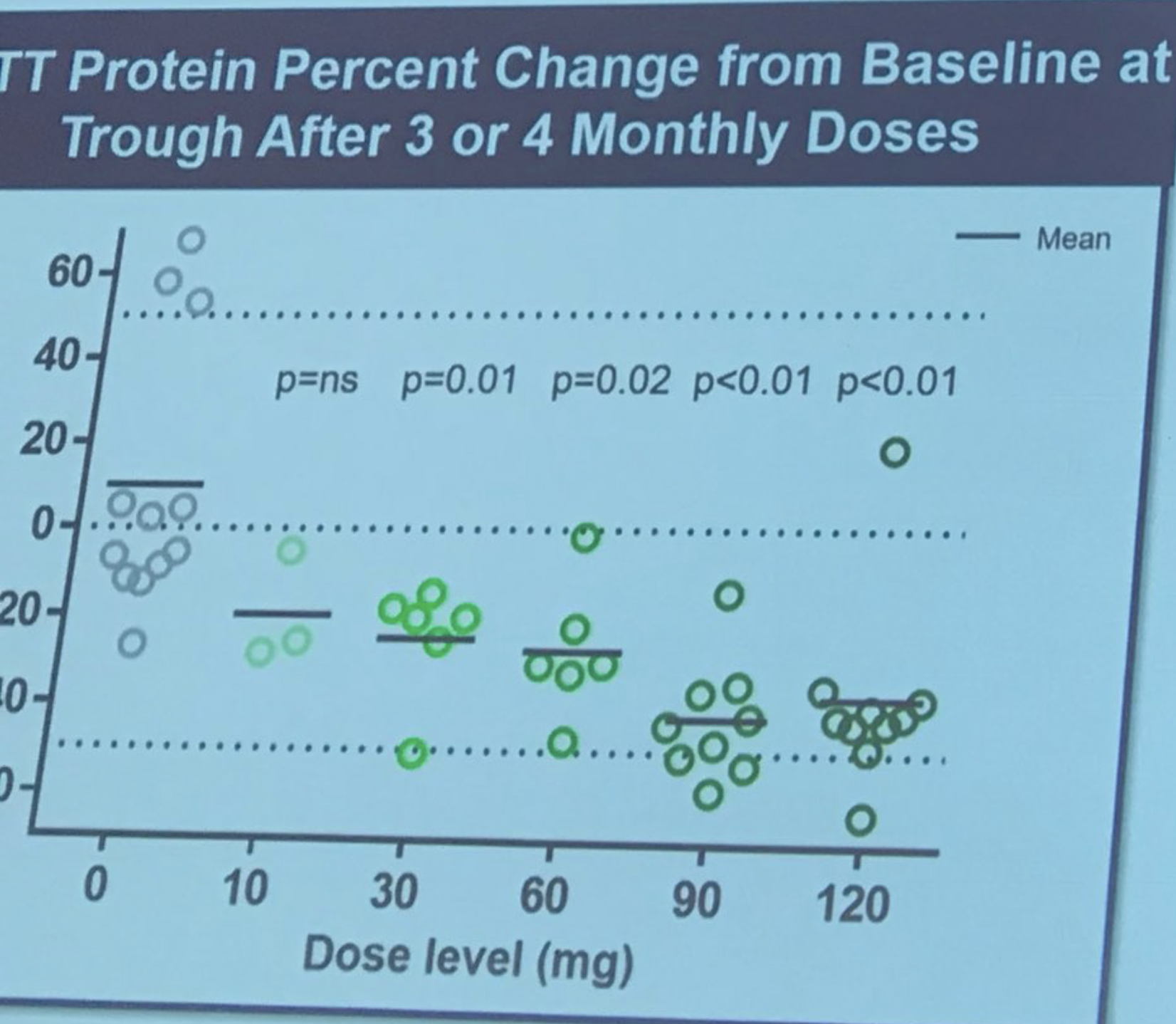
Sarah Tabrizi betreedt het podium om de eerste menselijke trial van Ionis/Roche’s ASO-behandeling te beschrijven. Deze studie was een “veiligheids”studie – de primaire reden voor het uitvoeren van de studie was om vast te stellen of het medicijn veilig was. De studie werd uitgevoerd op 9 locaties in het VK, Duitsland en Canada. ASO’s werden aan patiënten geleverd door infusie in het ruggenmergvocht in een “escalerende dosis”, wat betekent dat vroege deelnemers een lage dosis kregen en latere deelnemers hogere. Dit voorzichtige opschroeven van de dosis wordt gedaan om veiligheidsevaluaties mogelijk te maken door artsen onafhankelijk van de studie. Deze studie omvatte 46 ongelooflijk moedige vrijwilligers, die bereid waren enig risico te nemen door de eerste mensen te zijn die werden blootgesteld aan het medicijn. Onderzoekers waren in staat om de niveaus van het Huntingtine proteïne in het ruggenmergvocht te meten – waarvan ze eerder hadden aangetoond dat het zeer goed correleerde met hersenniveaus (die, onthoud, we niet direct kunnen meten).
De omvang van de verlaging is echt opvallend – gemiddeld wel 40-50%! Tabrizi beschrijft het gevoel van de onderzoekers dat de huntingtin-verlaging mogelijk nog tot 6 maanden kan blijven verbeteren. En dit is hoeveel Tabrizi voorspelt dat dit overeenkomt met herseneiwit-verlaging. Ionis heeft een soort model gebouwd waarmee ze voorspellingen kunnen doen over de relatie tussen huntingtin-verlaging in het ruggenmergvocht en in hersenweefsel. Dit suggereert dat huntingtin-verlaging in hersenweefsel behoorlijk hoog zou kunnen zijn. Patiënten werden zeer zorgvuldig gemonitord op veiligheid, er werden geen ernstige bijwerkingen gevonden. Tabrizi – “Het medicijn was veilig en werd goed verdragen bij alle geteste doses”. Succes! Alle deelnemers van de studie zitten nu in wat een “open label extensie” wordt genoemd – degenen die placebo kregen zijn overgestapt naar het medicijn en zullen blijven gemonitord worden. Spontaan applaus terwijl Tabrizi de moedige vrijwilligers in de eerste studie bedankt en hen “echte onderzoekshelden” noemt.
Wat een manier om de bijeenkomst af te sluiten – ongelooflijk spannende tijden in het vooruitzicht terwijl Roche en Ionis de volgende trial plannen, die ontworpen zal worden om te bepalen of het medicijn HD-symptomen verbetert bij grotere aantallen mensen.
Update: Ionis’ verklaring aan de gemeenschap over de resultaten.
Meer informatie
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


