
Oog in oog met tau: nieuwe inzichten in de chemische basis van de ziekte van Huntington
Draagt het tau-eiwit – dat problemen veroorzaakt bij andere neurodegeneratieve ziekten – bij aan de ziekte van Huntington?
We weten dat de oorzaak van de ziekte van Huntington een genetische verandering is, die resulteert in een schadelijk eiwit: gemuteerd huntingtine. Maar andere eiwitten kunnen in de strijd worden meegesleept en bijdragen aan de problemen waarmee cellen met HD te maken krijgen. Nieuw onderzoek suggereert dat een nogal berucht eiwit, genaamd ’tau’ – een bekende onruststoker bij andere degeneratieve hersenziekten – zich ophoopt en schade veroorzaakt bij HD.
Een rol voor tau bij HD?
Om effectieve behandelingen voor een ziekte te ontwikkelen, moeten we eerst begrijpen hoe deze de normale werking van het lichaam verstoort. We weten dat bij de ziekte van Huntington de aanwezigheid van een gemuteerd gen ervoor zorgt dat cellen een schadelijk eiwit produceren dat we
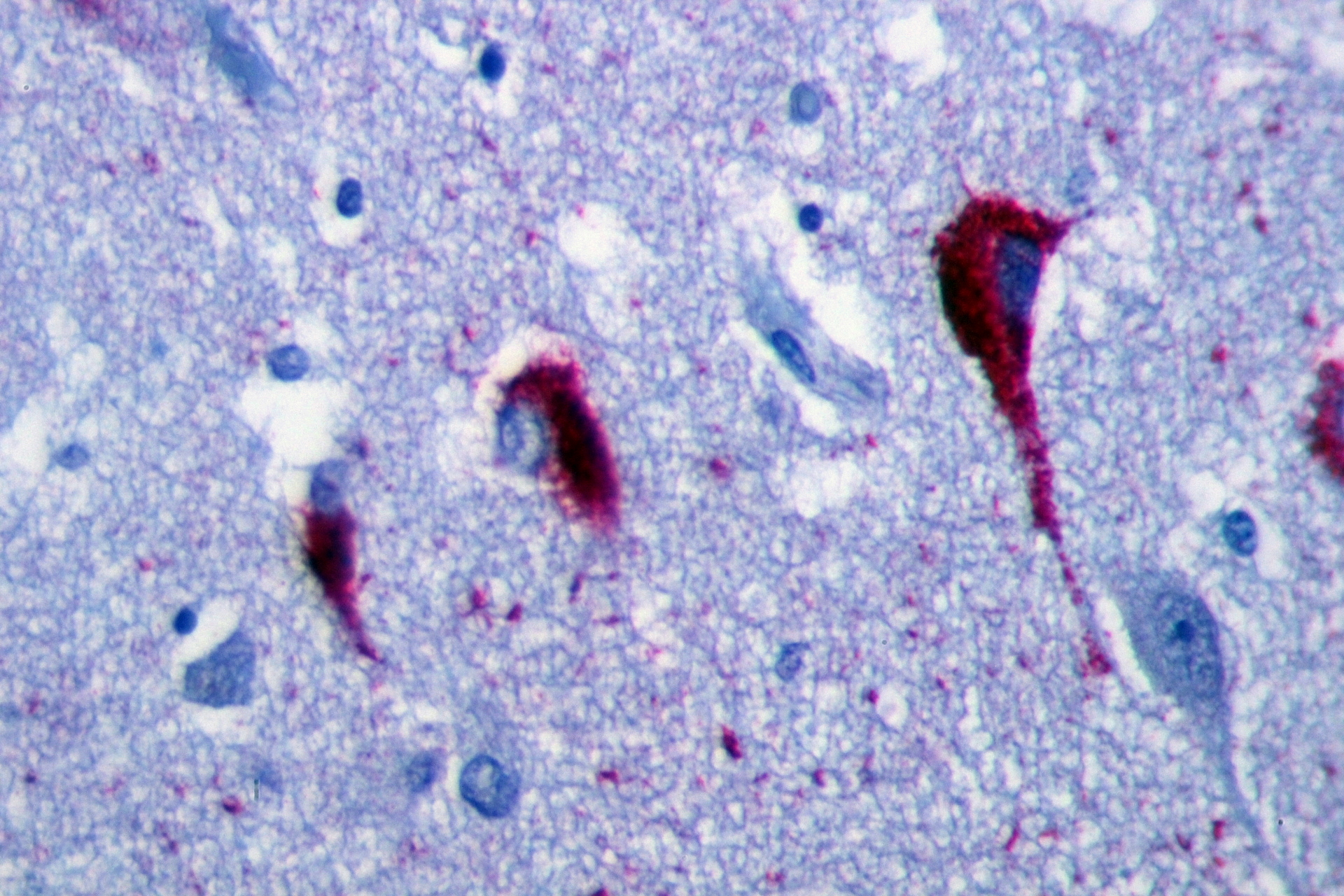
Afbeelding: Patho [CC-BY-SA-3.0]
Nieuw onderzoek van een groep in Spanje, onder leiding van Dr. Jose Lucas, heeft nu een verband aangetoond tussen het gemuteerde huntingtine-gen en een ander berucht eiwit genaamd tau.
Tau wordt gevonden in neuronen, waar het geassocieerd is met kleine structuren die microtubuli worden genoemd. Deze microtubuli fungeren als ‘steunbalken’ die de structuur van de cel in stand houden, zoals metalen frames gebouwen ondersteunen.
Bij zorgvuldig onderzoek van de hersenen van HD-patiënten die voor onderzoek waren gedoneerd, ontdekte het team van Lucas dat tau samengeklonterd voorkomt in staafvormige structuren in het controlecentrum of de ‘kern’ van neuronen, in plaats van in de microtubuli waar het normaal gesproken verblijft. Ze maten ook de totale hoeveelheid tau in HD-hersenen en ontdekten dat die onverwacht hoog was.
Er zijn verschillende vergelijkbare vormen van tau. De meest voorkomende worden ‘3-repeat’ en ‘4-repeat’ tau genoemd, vernoemd naar het aantal keren dat een bepaald ingrediënt in het uiteindelijke eiwit is opgenomen. Dit ingrediënt is belangrijk – het is het deel dat tau in staat stelt om aan microtubuli te hechten. Je kunt deze vormen van tau zien als hebbende 3 of 4 ‘handen’ om de microtubuli mee vast te pakken.
Naast het feit dat er meer tau-eiwit dan verwacht in HD-hersenen werd aangetroffen, ontdekte het team van Lucas dat de gebruikelijke balans van 3- en 4-repeat tau was verstoord – er was meer 4-repeat tau dan verwacht.
Snijden, hakken en splitsen
HD-hersenen hebben dus te veel tau, en te veel van dat tau is van het 4-repeat type, en het klontert samen tot vreemde staven. Wat veroorzaakt al deze tau-afwijkingen bij HD?
Laten we eerst eens kijken hoe cellen verschillende versies van hetzelfde eiwit maken.
“Dit stelt ons in staat om ‘op de schouders van reuzen te staan’ – we kunnen profiteren van wat Alzheimer- en FTD-onderzoekers al hebben geleerd over tau, hoe het problemen veroorzaakt en hoe we het kunnen bestrijden.”
Onze genen zijn als een receptenboek, geschreven in de chemische taal van DNA, dat cellen vertelt hoe ze alle verschillende eiwitten moeten bouwen die ze nodig hebben. Omdat deze recepten zo cruciaal zijn voor het normaal functioneren van cellen, blijven ze veilig bewaard in de kern. Om een eiwit te maken, maakt de cel eerst een ‘werkkopie’ van het recept, gemaakt van een DNA-achtig molecuul genaamd mRNA.
Net zoals sommige recepten optionele toevoegingen of variaties bevatten, bevatten veel genen ‘optionele’ informatie die niet essentieel is voor de eiwitproductie.
Onze cellen sorteren dus eerst het mRNA om instructies kwijt te raken die niet nodig zijn voor de specifieke variant van het eiwit dat wordt gemaakt.
Deze verwerking van mRNA wordt gedaan door een groep eiwitten die splitsende factoren worden genoemd. Ze werken om de ongewenste delen van het mRNA weg te knippen, waarbij alleen de delen overblijven die nodig zijn voor het maken van een eiwit.
In het geval van tau bevat een enkel genetisch recept instructies voor het maken van 3-repeat en 4-repeat tau. De versie die daadwerkelijk wordt gemaakt, hangt af van een splitsende factor genaamd
Aangezien zijn team meer 4-repeat tau dan verwacht had gevonden in de hersenen van HD-patiënten, vroeg het team van Lucas zich af of SRSF6 mogelijk actiever zou zijn bij HD. En inderdaad, ze vonden verhoogde niveaus van SRSF6 in HD-neuronen. Bovendien leek dat SRSF6 vast te zitten in de klonters van gemuteerd huntingtine. Het lijkt erop dat er een affiniteit is tussen SRSF6 en iets in die inclusies. Een kandidaat is het mRNA voor het gemuteerde huntingtine-eiwit, waarvan eerder is aangetoond dat SRSF6 eraan blijft plakken.
De onderzoekers toonden vervolgens vergelijkbare onevenwichtigheden aan van 3-repeat en 4-repeat tau in de hersenen van muizen met de HD-mutatie. En toen HD-muizen genetisch werden gemanipuleerd om minder tau te produceren, waren sommige van hun gebruikelijke HD-achtige bewegingsproblemen minder ernstig.
Vele vliegen in één klap slaan

De algemene boodschap van dit werk is dus dat het gemuteerde huntingtine-gen gemuteerd huntingtine-mRNA produceert, waaraan SRSF6 zich hecht. De verhoogde niveaus van SRSF6 veranderen vervolgens de balans van het mRNA voor een ander eiwit, tau – wat leidt tot de overproductie van de 4-repeat vorm van tau. De 4-repeat tau vormt vervolgens vreemde staafstructuren, die kunnen bijdragen aan de problemen van HD-hersenen.
Waarom is dit werk belangrijk? Waarom is het van belang dat er staven van 4-repeat tau worden gevormd in neuronen?
Tau heeft een beetje een reputatie. Het is in verband gebracht met andere ‘degeneratieve’ hersenziekten zoals de ziekte van Alzheimer en frontotemporale dementie (FTD), en nog veel meer.
Bij één vorm van FTD is de aanwezigheid van te veel 4-repeat tau in vergelijking met 3-repeat tau voldoende om neurodegeneratie te veroorzaken. Klinkt bekend! Dat is precies wat het Spaanse team waarnam in deze door HD aangetaste hersenen.
Bij de ziekte van Alzheimer vormt tau structuren die ‘neurofibrillaire kluwens’ worden genoemd, grote bundels tau-eiwit die neuronen beschadigen.
De opmerking dat tau mogelijk betrokken is bij HD kan handig zijn, omdat het ons in staat stelt om ‘op de schouders van reuzen te staan’ – we kunnen profiteren van wat Alzheimer- en FTD-onderzoekers al hebben geleerd over tau, hoe het problemen veroorzaakt en hoe we het kunnen bestrijden.
Betekent dit dat de ziekte van Huntington eigenlijk een tau-probleem is, of een ’tauopathie’, zoals onderzoekers aandoeningen noemen waarbij tau de boosdoener is? Niet echt – we weten zeker dat HD wordt veroorzaakt door een gemuteerd huntingtine-gen. Dus hoewel het lijkt dat tau betrokken kan zijn bij HD, is het zeker niet verantwoordelijk voor alle problemen die de mutatie veroorzaakt.
Deze nieuwe ziekteverbinding geeft ons een fascinerende nieuwe manier om na te denken over de ziekte van Huntington en hoe deze te behandelen – en dankzij de verbonden aard van de wetenschap hebben we al enig inzicht in wat er gebeurt wanneer tau in de strijd wordt meegesleept.
Meer informatie
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


