Nieuwe studie werpt licht op regionale degeneratie bij de ziekte van Huntington
Waarom sterven bepaalde hersencellen bij de ziekte van Huntington? Nieuw onderzoek suggereert dat dit te maken kan hebben met de efficiëntie van cellulaire recycling
Bepaalde hersengebieden degenereren sneller dan andere bij de ziekte van Huntington. Het team van Steven Finkbeiner concludeert dat deze discrepantie gebaseerd is op verschillende vermogens van hersencellen in deze gebieden om snel gemuteerd HD-eiwit te identificeren en op te ruimen. Specifiek zijn neuronen uit kwetsbare hersengebieden het traagst in het opruimen van het eiwit.
Weet wanneer je moet vouwen
Eiwitten zijn grote biologische moleculen die verschillende essentiële taken voor de cel uitvoeren. Nadat een eiwit is gemaakt door aminozuren in een specifieke volgorde aan elkaar te rijgen, vouwt het eiwit zich als een pretzel in een unieke driedimensionale vorm. Alleen wanneer het eiwit correct is gevouwen, kan het zijn normale taak uitvoeren.
Helaas worden sommige eiwitten onderweg veranderd, waardoor ze niet meer correct opvouwen. Bij de ziekte van Huntington zorgt een genetische mutatie ervoor dat een van de aminozuren in de keten van het huntingtine-eiwit (Htt) steeds opnieuw wordt herhaald, als een overgeslagen plaat (of een stotter, als platen voor jouw tijd zijn).
Deze uitbreiding zorgt ervoor dat Htt incorrect opvouwt, giftig wordt voor de cel, en samenklontert tot grote klompen die wetenschappers aggregaten noemen. Een passende vergelijking zou haarballen zijn die een afvoer verstoppen: losse, individuele haren zijn prima, maar de grote klompen verstoppen het.
Bij patiënten met de ziekte van Huntington lijkt elke cel in het lichaam gemuteerd HD-eiwit te bevatten, maar het zijn de hersencellen die bij voorkeur afsterven tijdens de ziekte. Daarom is de ziekte van Huntington een “neurodegeneratieve” aandoening. Sterker nog, niet alleen sterven hersencellen af, maar binnen de hersenen sterven bepaalde populaties neuronen het vroegst af en lijken dus het meest kwetsbaar.
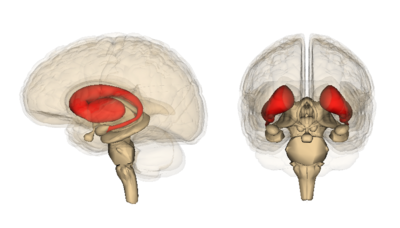
In het bijzonder vertoont het hersengebied dat het vroegst en meest ernstig celsterfte vertoont, het striatum. Het striatum ligt diep in het centrum van de hersenen. Het heeft als taak om vrijwillige bewegingen, gedachten en sociale interacties te coördineren en ervoor te zorgen dat dingen niet uit de hand lopen.
Alles, van het stoppen van een gesprek tot het stoppen van een beweging, wordt geregeld door het striatum. Wat extreem belangrijk is, maar momenteel niet begrepen wordt, is waarom dit gebied zo gevoelig is voor degeneratie bij de ziekte van Huntington, terwijl andere gebieden veel langer lijken om te gaan met gemuteerd Htt voordat ze afsterven.
“Neuronen die overladen waren met extra Nrf2 ruimden gemuteerd Htt sneller op dan normaal en hadden minder kans om af te sterven. Dit suggereert dat het opvoeren van de eigen recyclingweg van de cel een potentieel therapeutisch doelwit zou kunnen zijn bij de ziekte van Huntington.”
Ruim het papier en het afval en het gemuteerde huntingtine op
Twee mogelijke verklaringen voor deze verschillen werden onderzocht door een onderzoeksteam onder leiding van Dr. Steven Finkbeiner aan de Universiteit van Californië in San Francisco. Een mogelijkheid is dat er variabiliteit is tussen hersenceltypes in de snelheid waarmee gemuteerd Htt toxische structuren vormt. Kortom, hoe snel worden haren haarballen voor elk celtype?
Een andere mogelijke verklaring voor het selectieve verlies van cellen is dat verschillende hersengebieden gemuteerd Htt op verschillende manieren opruimen en verwijderen. Zijn sommige cellen gewoon netheidsfreaks?
De auteurs bedachten een techniek waarmee ze deze vouw- en opruimeigenschappen konden meten in individuele levende gekweekte hersencellen. Ze vulden de cellen met een gloeiend eiwit genaamd “Dendra2”. Dit eiwit is bijzonder, omdat het aanvankelijk groen gloeit (zoals een glow stick speelgoed voor kinderen), maar dit verandert in een rood gekleurd licht wanneer het wordt verlicht met een specifieke kleur licht.
Dus, deze tool stelt je in staat om wat neuronen vol met groen dendra2 te kweken, en ze dan te beschieten met een licht dat de dendra2 rood maakt. Door te kijken hoe lang het duurt voordat de cel groen dendra2 aanvult en het rode dendra2 kwijtraakt, kun je zien hoe snel die cel nieuwe eiwitten maakt (groen) en oude afbreekt (rood).
Afbeelding: Life Science Databases
Natuurlijk geven we niet echt om dendra2. Wat we echt willen weten is hoe hersencellen omgaan met het normale HD-eiwit, en of dit verandert door de mutatie die de ziekte van Huntington veroorzaakt. Om deze vraag te beantwoorden, gebruikten de wetenschappers laboratoriumtrucs om een normaal of gemuteerd HD-eiwit te fuseren met het dendra2-eiwit. Nu konden ze dezelfde lichttruc gebruiken om het HD-eiwit te volgen.
De vuilnisman kan het
Met dit systeem merkten ze op dat gemuteerd HD-eiwit veel sneller uit neuronen in het striatum werd verwijderd dan normaal Htt. Dit is verrassend – veel wetenschappers zouden hebben voorspeld dat de gemuteerde vorm van het eiwit langer zou blijven hangen, en dat dit langere verblijf ervoor zorgt dat het ophoopt in aggregaten. Het suggereert dat neuronen in staat zijn om het gemuteerde eiwit te herkennen en het te markeren voor verwijdering.
In feite stelde de geautomatiseerde microscoop die Finkbeiner’s team heeft ontwikkeld hen in staat om te zien dat hoe sneller een individuele cel van gemuteerd Htt af kwam, hoe langer die cel leefde. Dat is logisch – het opruimen van het giftige afval beschermt hersencellen.
Dus, als het detectie- en inperkingssysteem van de cel voor gemuteerde eiwitten werkt, waar zit dan het probleem? Het blijkt dat sommige neuronen beter zijn in deze opruiming dan andere, namelijk die van de cortex. De cortex is het gerimpelde buitenste deel van de hersenen. Over het algemeen bezwijken cellen in de cortex later aan de ziekte van Huntington dan cellen in het striatum. In de hoop te begrijpen waarom, vergeleken de auteurs de opruiming van het gemuteerde HD-eiwit in het striatum met de opruiming in de cortex.
“De belangrijkste bevinding van deze studie is dat neuronen uit verschillende hersengebieden inderdaad verschillen in hun gevoeligheid voor gemuteerd Htt. Het kan een verklaring bieden voor waarom de ziekte van Huntington op de ene plek in de hersenen begint in plaats van op een andere.”
En inderdaad, neuronen in de cortex waren in staat om sneller van gemuteerd Htt af te komen. Neuronen van de cortex leefden ook langer dan neuronen van het striatum. De auteurs concludeerden dat dit komt doordat deze gebieden recyclingpaden hebben die verschillen in hun vermogen om het gemuteerde HD-eiwit op te ruimen.
Wanneer eiwitten oud of versleten raken, heeft de cel een systeem om ze af te breken of te recyclen. De onderzoekers onderzochten of hun waarnemingen konden worden verklaard door effecten op dit afbraaksysteem. In het bijzonder richtten ze zich op Nrf2, een eiwit dat het recyclingpad activeert.
Wetenschappers kunnen bestuderen hoe verschillende cellulaire processen bijdragen aan dingen zoals celdood en recycling door het volume van een bepaald proces op te voeren, of terug te draaien. In dit geval, omdat ze geloofden dat de recyclingprogramma’s die worden aangezet door het Nrf2-eiwit belangrijk zijn, kunnen ze cellen meer Nrf2 geven, of het wegnemen. Dit helpt hen vast te stellen of een specifiek proces belangrijk is.
Dit is precies wat ze deden om Nrf2 en de recycling van het gemuteerde HD-eiwit te bestuderen. Neuronen die overladen waren met extra Nrf2 ruimden gemuteerd Htt sneller op dan normaal en hadden minder kans om af te sterven. Dit suggereert dat het opvoeren van de eigen recyclingweg van de cel een potentieel therapeutisch doelwit zou kunnen zijn bij de ziekte van Huntington.
In overeenstemming met dit idee, toen de wetenschappers kunstmatig de primaire afval- of recyclingpaden van de cel verminderden met medicijnen, waren de cellen minder in staat om gemuteerd HD-eiwit op te ruimen. Dus deze specifieke recyclingweg lijkt cruciaal voor het vermogen van neuronen om met dit toxische eiwit om te gaan.

Afbeelding: Chris Goodfellow
Wat betekent dit voor de ZvH?
De belangrijkste bevinding van deze studie is dat neuronen uit verschillende hersengebieden inderdaad verschillen in hun gevoeligheid voor gemuteerd Htt. Het kan een verklaring bieden voor waarom de ziekte van Huntington op de ene plek in de hersenen begint in plaats van op een andere. De nette twist is dat deze gevoeligheid lijkt te zijn gebaseerd op de verschillende vermogens van deze neuronen om de gemuteerde eiwitten te beheren en op te ruimen, in plaats van op een intrinsieke toxiciteit van het eiwit zelf.
Dit is eigenlijk heel belangrijk, omdat het vermogen van neuronen om gemuteerd Htt te beheren een interessante weg biedt voor potentiële therapieën. Op basis van de resultaten van deze studie zouden we verwachten dat behandelingen die het vermogen van neuronen om gemuteerd Htt op te ruimen versterken, neuronen zouden helpen langer te leven.
Deze interessante mogelijkheid moet echter in context worden beschouwd. Ten eerste werd deze hele studie uitgevoerd met neuronen die in een schaaltje werden gekweekt. Het moet nog blijken of dit fenomeen ook zal worden waargenomen bij de menselijke ziekte, wat uiteindelijk het belangrijkst is.
Ten tweede zijn deze bevindingen voorlopig, aangezien de mogelijke therapieën die hierboven worden beschreven nog niet bestaan. Het zal tijd kosten om iets geschikts te bedenken en het te testen in andere HD-modellen voordat het bij mensen kan worden geprobeerd. Niemand weet bijvoorbeeld welke nadelige bijwerkingen er zouden kunnen optreden als de Nrf2-route langdurig kunstmatig zou worden opgevoerd.
De conclusie is dat deze waarnemingen zeer intrigerend fundamenteel HD-onderzoek zijn. En hoewel er nog steeds geen goedgekeurde medicijnen zijn die het onderliggende probleem bij de ziekte van Huntington aanpakken, helpen studies als deze om een beter begrip te krijgen van deze vreselijke aandoening en maken ze de weg vrij voor de ontwikkeling van nieuwe medicijnen.
Meer informatie
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


