Een DNA-reparatie-eiwit beïnvloedt de stabiliteit van lange CAG-reeksen in het gen voor de ziekte van Huntington
DNA-reparatie is een cruciaal proces voor cellen, maar fouten in dit proces kunnen mogelijk ‘repeat-instabiliteit’ bij de ziekte van Huntington verklaren
Het eiwit MSH3 vervult een belangrijke functie in cellen door genetische fouten en beschadigd DNA op te sporen en te helpen repareren. Een nieuwe studie van wetenschappers aan de Universiteit van Toronto, Hospital for Sick Children, suggereert echter dat MSH3 de progressie van de ziekte van Huntington kan bevorderen door CAG-repeat instabiliteit in de hersenen te verhogen.
Het probleem van genetische instabiliteit
De fundamentele oorzaak van de ziekte van Huntington is goed vastgesteld. Een herhalend segment van drie bouwstenen van de genetische code Cytosine-Adenosine-Guanine (of simpelweg ‘C-A-G’) nabij het begin van het HD-gen is buitensporig lang bij mensen die de ziekte ontwikkelen.
De CAG-herhaling vertoont grote diversiteit in de bevolking, zelfs bij niet-aangedane personen. Normale herhalingslengtes kunnen variëren van 6 tot 36, terwijl herhalingen langer dan 40 onvermijdelijk leiden tot de ziekte van Huntington.
Maar de CAG-herhalingslengte heeft ook andere, voorspellende eigenschappen. Het aantal herhalingen kan niet alleen bepalen of iemand de ziekte van Huntington zal ontwikkelen, maar kan ook ruwweg voorspellen op welke leeftijd ziektesymptomen kunnen beginnen te verschijnen. Hoe langer de herhalingslengte, hoe eerder de ZvH gemiddeld begint.
In families die de mutatie dragen, vertoont de ZvH soms ‘anticipatie’ – een technische manier om te zeggen dat het begin van de ziekte met elke volgende generatie vroeger kan optreden. Wetenschappers hebben ontdekt dat deze anticipatie kan worden verklaard door een biologisch verschijnsel dat ‘genetische instabiliteit’ wordt genoemd.
Instabiliteit verwijst naar de neiging van repetitieve stukken DNA om gedurende iemands leven te groeien. Dit kan bijvoorbeeld veroorzaken dat het C-A-G-gebied in het HD-gen langer wordt.
Om redenen die niet begrepen worden, komt genetische instabiliteit vaker voor in sommige weefsels en celtypen dan in andere. Terwijl herhalingslengtes bijvoorbeeld vrij stabiel zijn in het bloed (waar monsters worden verzameld voor HD-genetische tests), breiden ze zich vaak uit in zaadcellen.
Deze genetische instabiliteit verklaart waarom anticipatie voorkomt bij de ZvH. Herhalingen worden gemiddeld langer, waardoor kinderen eerder symptomen krijgen dan hun ouders. Omdat deze uitbreiding vooral voorkomt in zaadcellen, zijn uitbreidingen waarschijnlijker in HD-genen die van vaders zijn geërfd dan van moeders.
De intergenerationele effecten van genetische instabiliteit zijn al geruime tijd bekend. Nieuwere studies werpen echter licht op hoe het ook de ziekteprognose binnen individuele patiënten kan beïnvloeden.
Instabiliteit in de hersenen
Hersenschade bij de ziekte van Huntington heeft een specifiek patroon: niet alle delen van de hersenen degenereren in dezelfde mate. De delen van de hersenen die het meest kwetsbaar zijn voor afsterven bij de ZvH worden het striatum en de cerebrale cortex genoemd. Interessant is dat wetenschappers hebben ontdekt dat deze hersengebieden ook de gebieden zijn die de meest significante niveaus van repeat-instabiliteit vertonen.
Aangezien de herhalingslengte zo nauw verbonden is met de beginleeftijd van de ZvH, zou de verlenging van de CAG-herhaling binnen deze hersengebieden mogelijk kunnen verklaren waarom ze selectief verloren gaan bij de ziekte. Ter ondersteuning van dit idee blijkt dat ZvH-patiënten die de ernstigste hersenschade vertonen, degenen zijn met de hoogste niveaus van CAG-repeat instabiliteit.
Deze bevindingen roepen een belangrijke vraag op. Waarom hebben sommige ZvH-patiënten hogere niveaus van genetische instabiliteit in de hersenen? Welk probleem komt eerst: veroorzaakt meer hersenschade verhoogde instabiliteit, of veroorzaakt instabiliteit ergere hersenschade?
In een poging om dit probleem direct aan te pakken, zocht een team onder leiding van Dr. Christopher Pearson in het Hospital for Sick Children in Toronto naar genen die verschillen in genetische instabiliteit van persoon tot persoon zouden kunnen controleren. In deze zoektocht kwam één gen, genaamd MSH3, naar voren als de belangrijkste kandidaat.
“Helaas is een bijproduct van het reparatieproces dat er per ongeluk extra CAG-herhalingen aan de sequentie kunnen worden toegevoegd. Net als bij een lawine wordt het oorspronkelijke probleem groter naarmate er meer herhalingen worden toegevoegd. Dit is de kern van genetische instabiliteit.”
Het bewijs
Om te zoeken naar genen die genetische instabiliteit zouden kunnen controleren, voegden de onderzoekers een klein maar toxisch fragment van het gen voor de ziekte van Huntington toe aan twee verschillende stammen muizen. Verschillende muizenstammen zijn een soort mensen uit verschillende families, of verschillende hondenrassen – hoewel het allemaal muizen zijn, hebben ze verschillende genetische achtergronden.
De onderzoekers ontdekten dat genetische instabiliteit van het Huntington-gen voorkwam in één muizenstam (B6 genoemd), maar niet in de andere (CBy genoemd). Op basis van eerder onderzoek naar genetische instabiliteit, uitgevoerd door het Pearson-lab en anderen, vermoedden de onderzoekers dat het dramatische verschil tussen de muizen zou kunnen worden teruggebracht tot verschillen in één bepaald biologisch proces, genaamd mismatch repair, en meer specifiek een van de belangrijkste spelers daarin, het MSH3-eiwit.
Om te testen of genetische verschillen in MSH3 de verandering in repeat-instabiliteit veroorzaakten, brachten de wetenschappers het MSH3-gen over van CBy-muizen (die eerder geen CAG-repeat expansie vertoonden) naar de B6-stam, en vice versa.
De resultaten waren dramatisch. Het omwisselen van de genen tussen de muizenstammen veroorzaakte een complete omkering van repeat-instabiliteit. De CBy-muizen, die voorheen immuun waren voor toenames in herhalingslengte, waren nu de stam met de hoogste niveaus, terwijl de B6-stam vrijwel geen repeat-instabiliteit meer vertoonde. Het effect volgde het MSH3-gen!
Om te bepalen wat het verschil zou kunnen veroorzaken, bekeken de onderzoekers de genetische sequenties van het MSH3-gen van beide muizenstammen. In de CBy-stam werd een enkele mutatie geïdentificeerd die een significant effect bleek te hebben op de functie van MSH3. Deze enkele mutatie zorgde ervoor dat het MSH3-eiwit instabiel werd en snel werd afgebroken door de cel. Als gevolg hiervan werd alle MSH3 die door de cellen werd gemaakt snel afgebroken en gerecycled, waardoor het algemene niveau aanzienlijk werd verlaagd.
Deze bevindingen suggereerden twee dingen: dat als een persoon van nature een vergelijkbare mutatie in hun MSH3-gen zou dragen, ze ook verminderde CAG-repeat instabiliteit zouden kunnen hebben, en dus een betere ziekteprognose, en ten tweede, dat het ontwikkelen van medicijnen gericht op MSH3 waardevol zou kunnen zijn voor de behandeling van de ziekte van Huntington, aannemende dat instabiliteit belangrijk is.
Mismatch repair en het MSH3-eiwit
Wat doet MSH3 precies, en hoe zou het de prognose van de ziekte van Huntington kunnen beïnvloeden? Om dit het beste uit te leggen, moeten we eerst iets leren over dat zo belangrijke biologische proces dat eerder werd genoemd, DNA mismatch repair.
DNA-reparatie is in het algemeen een noodzakelijk proces dat onze cellen in staat stelt om fouten, of mutaties, die ontstaan in onze genetische code te corrigeren. Deze mutaties kunnen worden veroorzaakt door verschillende gebeurtenissen, sommige door normale cellulaire activiteiten en sommige door omgevingsschade, zoals UV-licht of chemicaliën. Sommige genetische beschadigingen kunnen breuken in het DNA veroorzaken, terwijl andere enkele mutaties introduceren – veranderingen in de volgorde van letters in DNA.
Mismatch repair-eiwitten, zoals MSH2, MSH3 en MSH6 zoeken naar twee verschillende soorten genetische fouten: ‘mismatches’ die ontstaan wanneer DNA wordt gekopieerd in delende cellen, en kleine lussen die kunnen ontstaan binnen DNA na een enkele strengbreuk.
CAG-herhalingen die de ZvH veroorzaken zijn bijzonder gevoelig voor de vorming van deze kleine DNA-lussen. De reden houdt verband met fundamentele eigenschappen van DNA die het mogelijk maken dat het wordt gekopieerd binnen de cel.
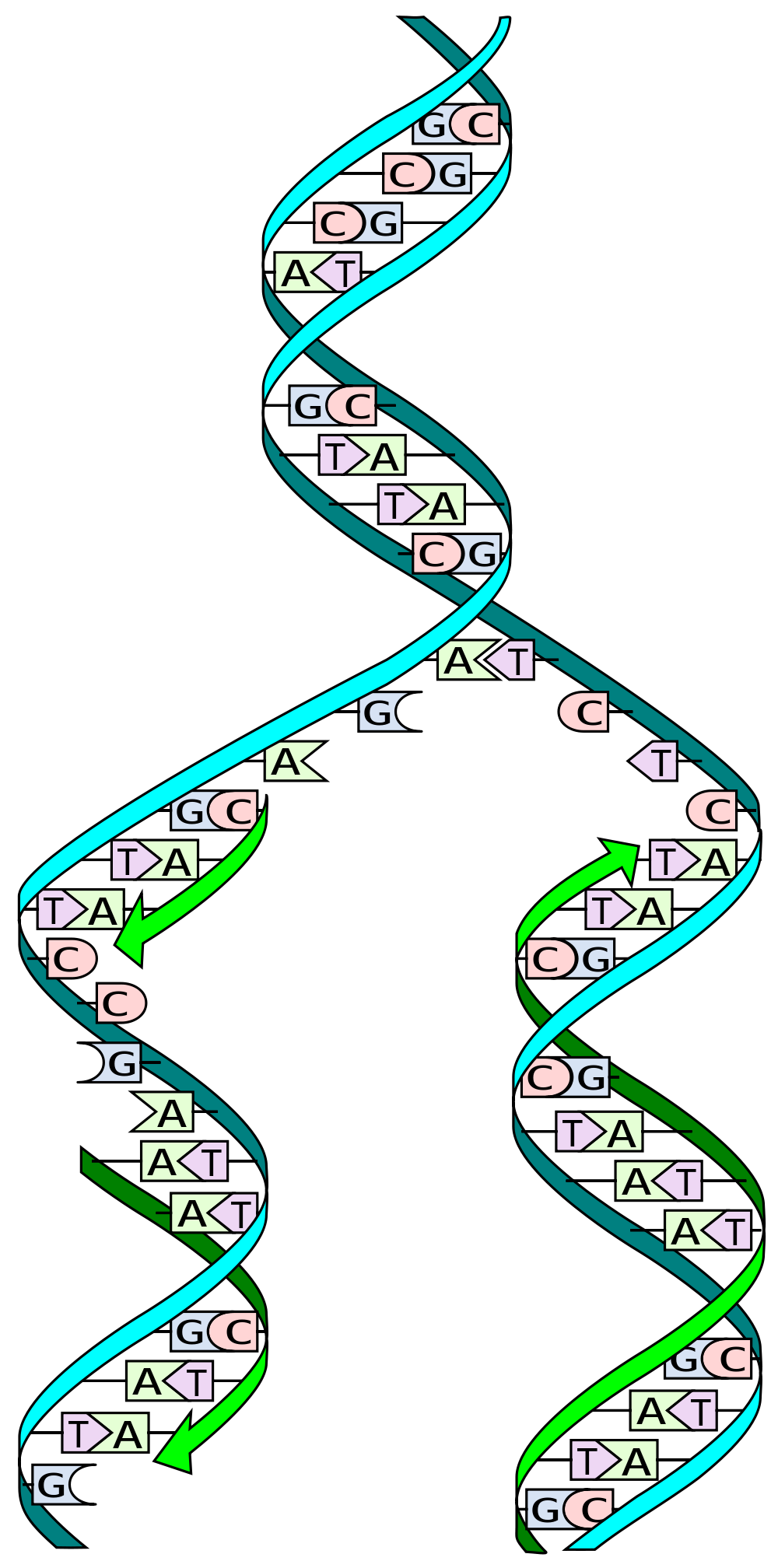
Afbeeldingscredit: Madeleine Price Ball
Veel mensen hebben gehoord dat DNA een ‘dubbele helix’ is. Dit betekent in feite dat het bestaat uit twee strengen die een spiraalvormige structuur vormen. Deze DNA-strengen worden vaak beschreven als kopieën van elkaar, of een spiegelbeeld, maar dit is slechts gedeeltelijk waar.
DNA bestaat uit slechts 4 verschillende genetische bouwstenen die nucleotiden worden genoemd, namelijk cytosine ©, guanine (G), adenosine (A) en thymidine (T). C heeft een natuurlijke affiniteit voor G, terwijl A wordt aangetrokken tot T.
Wanneer DNA wordt gerepliceerd, wordt de dubbele helix uit elkaar getrokken in twee individuele strengen. Gespecialiseerde moleculaire machines, ‘polymerasen’ genoemd, lezen vervolgens de genetische code, letter voor letter, en genereren een nieuwe tweede streng en daarmee een nieuwe kopie van het DNA.
Om dit te doen, maken de polymerasen gebruik van de natuurlijke affiniteiten van de nucleotiden. Bijvoorbeeld, wanneer de machinerie een C in de genetische sequentie tegenkomt, recruteert het een G in de groeiende DNA-streng, en wanneer het een T detecteert, koppelt het deze aan een A. Dit is waarom we zeggen dat de twee DNA-strengen niet exact een kopie van elkaar zijn. Ze verschaffen de informatie om de tweede streng te maken, maar ze zijn geen replica.
Laten we nu terugkeren naar de CAG-herhalingen. Wanneer één streng DNA breekt nabij of binnen een lange CAG-herhaling, kan die streng vrijkomen om een lus te vormen door de natuurlijke affiniteit van C’s en G’s binnen zijn sequentie.
Twee mismatch repair-eiwitten, MSH2 en MSH3 komen samen om deze soorten DNA-lussen op te sporen en te repareren. Helaas is een bijproduct van het reparatieproces dat er per ongeluk extra CAG-herhalingen aan de sequentie kunnen worden toegevoegd. Net als bij een lawine wordt het oorspronkelijke probleem groter naarmate er meer herhalingen worden toegevoegd. Dit is de kern van genetische instabiliteit.
Wat gebeurt er dus precies in de CBy-muizen waardoor ze resistent zijn tegen repeat-expansie? Onthoud dat de onderzoekers ontdekten dat de CBy-muizen een mutatie hadden in de genetische sequentie van MSH3 die ervoor zorgde dat het eiwit instabiel werd. Met minder MSH3 beschikbaar om DNA-lussen binnen de CAG-herhaling van het HD-gen te vinden en te corrigeren – waarbij mogelijk extra CAG’s worden geïntroduceerd in het proces – kwam genetische instabiliteit tot stilstand.
Wat is de volgende stap?
Wat betekent dit allemaal voor patiënten met de ziekte van Huntington? Op dit moment suggereert het alleen dat een van de redenen waarom er variatie is in de beginleeftijd tussen mensen met gelijke herhalingslengtes zou kunnen zijn vanwege verschillende mogelijkheden van hun MSH3-eiwitten om deze DNA-lussen te repareren. Als er mensen zouden zijn die een vergelijkbare mutatie dragen als die gevonden in de muizen, zouden zij mogelijk een vertraagde ziekteprogressie hebben.
In theorie suggereert de studie ook dat als we de activiteit van het MSH3-eiwit bij ZvH-patiënten zouden kunnen aanpassen, we de hoeveelheid repeat-instabiliteit in hun HD-gen zouden kunnen modificeren. Als repeat-instabiliteit belangrijk is voor de ontwikkeling van de ZvH, zou dit theoretisch de ontwikkeling van de ziekte kunnen vertragen.
De uitdaging van het richten op MSH3 is echter dat DNA-reparatie een belangrijk proces is voor alle cellen in het lichaam. Als mutaties in genen niet efficiënt kunnen worden gecorrigeerd, hebben ze de potentie om zich op te hopen en kanker te veroorzaken. Het moet nog blijken of verstoring van MSH3-activiteit voldoende kan worden getolereerd om het begin van de ZvH te voorkomen, zonder andere ernstige ziekten te veroorzaken.
Deze studie doet geen beloften over het therapeutische potentieel van het onderzoek, maar ze hebben zeker interesse gewekt in het volgen van MSH3 bij patiënten. Hoe meer we weten over verschillende genen die de ziekte van Huntington kunnen beïnvloeden, hoe beter de informatie kan worden gebruikt om verbeterde patiëntenzorg te bieden door nauwkeurigere ziekteprognose.
Meer informatie
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


