Huntington’s ziekte de vinger geven? Twee teams melden succes voor zinkvingerbehandelingen in cellen en muizen
Succes in Huntington-cellen en -muizen voor zinkvingerbehandelingen die de productie van het schadelijke eiwit verminderen

Het ontwerpen van medicijnen die onze cellen vertellen om minder van het schadelijke mutante huntingtine-eiwit te produceren, is een van de meest veelbelovende benaderingen voor de behandeling van de ziekte van Huntington. De meeste pogingen om huntingtine te verlagen hebben tot nu toe geprobeerd om ‘de boodschapper neer te schieten’ in plaats van de bron van de boodschap aan te pakken – het DNA zelf. Nu hebben twee onafhankelijke succesmeldingen bij HD-muizen een boost gegeven aan ‘zinkvinger’-medicijnen – die direct interageren met het HD-gen zelf. Het is nog vroeg voor deze nieuwe technologie: wat weten we, en welke uitdagingen liggen voor ons?
Wat zijn zinkvinger-eiwitten in hemelsnaam?
Zink is een glanzend metaal dat wordt gevonden in ‘zilveren’ munten, batterijen en witte verf. Maar ons eigen lichaam gebruikt zink voor een intrigerend doel – dat onderzoekers hopen te kapen om de ziekte van Huntington te bestrijden. Het blijkt dat zink van vitaal belang is om cellen in staat te stellen de activiteitsniveaus van verschillende genen in ons DNA te controleren.
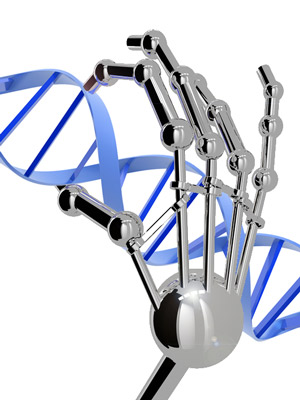
Onthoud dat een gen een set instructies is, gespeld met de chemische ‘letters’ A, C, G en T. Elk gen heeft een andere volgorde van letters, en cellen gebruiken zink-bevattende eiwitten om individuele genen te helpen controleren op basis van hun specifieke lettervolgorde.
Wanneer zink zich verbindt met een gen-controlerend eiwit, vormt het ‘zinkvinger-eiwitten’ – zo genoemd omdat ze in de nauwe groef tussen de twee strengen DNA kunnen prikken en de sequentie kunnen aanraken waarvoor ze gemaakt zijn.
Een enkele zinkvinger kan drie letters ‘kietelen’, afhankelijk van de rangschikking van de zink- en eiwitdelen waaruit hij bestaat. Dus één zinkvinger zou kunnen hechten aan de sequentie ‘ATG’, terwijl een andere voor ‘CAG’ zou kunnen gaan.
Het spannende is dat individuele zinkvingers in volgorde aan elkaar kunnen worden gekoppeld. Als je die twee aan elkaar koppelt, eindig je met één molecuul dat hecht aan de 6-letter sequentie ATG-CAG.
Designer vingers
Na tientallen jaren werk aan het ontcijferen en begrijpen van de werking van DNA en onze genen, kunnen wetenschappers nu synthetische zinkvingers creëren, ontworpen om aan elke DNA-sequentie te hechten die ze willen.
Bovendien kunnen deze synthetische zinkvingermoleculen worden aangepast en verpakt met andere medicijnen, om veelzijdige DNA-bindende hulpmiddelen te produceren die kunnen hechten, snijden, lijmen en blokkeren.
Omdat de ziekte van Huntington wordt veroorzaakt door een enkel defect gen, is het een goede kandidaat voor zinkvinger-medicijnonderzoek.
De ziekte van Huntington ontstaat wanneer iemand een spelfout heeft in het gen dat cellen vertelt hoe ze een bepaald eiwit moeten maken – genaamd huntingtine. Wanneer iemand te veel CAG’s op een rij heeft aan het begin van het huntingtine-gen, wordt er een schadelijke ‘gemuteerde’ vorm van het eiwit geproduceerd op basis van de instructies in het gen.
Het HD-gen bij de bron blokkeren
Twee groepen onderzoekers – een academisch team uit Barcelona, Spanje; de andere een biotechbedrijf uit Californië genaamd Sangamo – hebben zojuist succesvolle experimenten aangekondigd met zinkvinger-medicijnen gericht op het Huntington-gen.
De resultaten van het Spaanse team werden onlangs gepubliceerd in het tijdschrift PNAS. Sangamo’s bevindingen werden gepresenteerd op de recente Society for Neuroscience bijeenkomst in New Orleans, waar HDBuzz aanwezig was.
Beide teams ontwierpen zinkvingermoleculen die zouden hechten aan het ‘CAG-traject’ van het huntingtine-gen, en cellen vertellen het gen niet te lezen.
De zinkvinger-ketens werden gekozen en verfijnd om te proberen ze zoveel mogelijk te laten hechten aan schadelijk lange CAG-stukken zonder te hechten aan stukken van normale lengte. Het Spaanse team noemde dit op pakkende wijze een ‘moleculaire meetlint’-benadering.
Na wat chemisch sleutelwerk testte elk team vervolgens hun beste kandidaat-zinkvinger recepten in cellen die in een petrischaal groeiden.
“Zodra een zinkvinger een bepaalde DNA-sequentie heeft getarget, zijn er theoretisch veel spannende dingen mogelijk.”
Viraal gaan
Helaas kunnen wetenschappers niet zomaar een zinkvinger-medicijn ontwerpen en maken en het op cellen spuiten, of het in een pil stoppen. Als eiwitten zijn zinkvinger-medicijnen groot, complex en kwetsbaar. Als ze als tablet worden ingenomen, zou het medicijn worden afgebroken door het spijsverteringssysteem.
Zelfs als het als injectie in het bloed wordt gegeven, zou het zinkvinger-eiwit de hersenen niet bereiken, laat staan de kern van onze neuronen, waar het moet zijn om zijn werk te doen.
Om dit probleem op te lossen, kunnen onderzoekers virussen gebruiken om ‘mee te liften’ naar de kern van cellen.
Na het kiezen van de zinkvinger-eiwitketen die ze willen, is het vrij eenvoudig om een DNA-sequentie te ontwerpen die cellen zal vertellen om precies dat eiwit te maken. Die DNA-sequentie kan dan worden vastgezet in deeltjes van een virus genaamd AAV, dat onschadelijk is, maar goed in het infecteren van neuronen.
Wanneer het virus een geschikte cel tegenkomt, injecteert het zijn DNA-lading in de cel, waardoor de cel verandert in een fabriek voor het maken van het zinkvinger-medicijn!
Testen in cellen
Het Spaanse team verfijnde hun beste zinkvinger-kandidaten in verschillende soorten genetisch gemanipuleerde cellen en cellen gekweekt uit de huid van patiënten met de ziekte van Huntington. De Sangamo-onderzoekers gebruikten deze HD-patiëntcellen ook, evenals hersencellen van een HD-muismodel.
De zinkvinger-medicijnen van beide teams deden het werk van het verminderen van de activiteit van genen die lange CAG-stukken bevatten.
Off-target effecten
Er is hier een mogelijk probleem. Het huntingtine-gen is niet het enige met een lang CAG-stuk – veel andere genen hebben dat ook. Dus een medicijn dat zich richt op CAG-stukken zou die genen ook kunnen uitschakelen, wat uiteindelijk meer kwaad dan goed zou kunnen doen.
Een eigenaardigheid van het huntingtine-gen kan nuttig zijn als het gaat om het vermijden van deze ‘off-target effecten’. Het CAG-stuk in het huntingtine-gen bevindt zich toevallig zeer dicht bij het begin van het gen, waar de effecten van zinkvinger-medicijnen het sterkst werken.
Beide groepen deden metingen om te zien of andere genen werden beïnvloed door het zinkvinger-medicijn, en vonden resultaten die over het algemeen geruststellend waren. Alle effecten waren klein vergeleken met de gewenste werking op het gemuteerde huntingtine-gen.
Breng de muizen maar op
Het Spaanse team, dat wat verder is met hun werk, bracht de zaken naar het volgende niveau door hun beste zinkvinger-kandidaat te testen in een muismodel van de ziekte van Huntington.
Ze gaven de muizen een enkele injectie in de hersenen, met virusdeeltjes gevuld met DNA-instructies voor het maken van het zinkvinger-medicijn.
De activiteit van het gemuteerde huntingtine-gen werd met ongeveer 50% verminderd in de hersenen nabij de injectieplaats. Het voorkomen van klonters van gemuteerd huntingtine-eiwit werd ook met ongeveer 40% verminderd. Er was geen bewijs van schadelijke effecten zoals gewichtsverlies, maar de studie was te klein om te weten of het zinkvinger-medicijn de symptomen verbeterde.
Wacht even – is dit niet gewoon gen-onderdrukking?
Als wat je hier hebt gelezen over zinkvinger-technologie je doet denken aan ‘gen-onderdrukking’ of ‘huntingtine-verlagende’ methoden voor de behandeling van de ziekte van Huntington, geef jezelf dan een gouden ster. Wat deze groepen proberen is in wezen ‘gen-onderdrukking’, met een twist – het is direct gericht op het DNA, in plaats van zich te richten op een ‘boodschapper-molecuul’ genaamd RNA.
Tot nu toe hebben de meeste pogingen om de huntingtine-productie te verlagen zich gericht op het RNA-boodschapper-molecuul, omdat het gemakkelijker is om medicijnen te ontwerpen die RNA targeten dan DNA. RNA zweeft in enkele streng rond in cellen, terwijl DNA verborgen zit in de kern van onze cellen. Bovendien bestaan RNA-onderdrukkende medicijnen al langer, en sommige hoeven niet te worden verpakt in virusdeeltjes.
Aangezien RNA-gebaseerde gen-onderdrukkende medicijnen tot nu toe succesvol zijn geweest, waarom zou je je dan bezighouden met de grotere uitdaging van het targeten van het DNA van het huntingtine-gen zelf, vooral als dat betekent dat je moet omgaan met virusdeeltjes en grote, kwetsbare medicijnen gemaakt van eiwit? Het is een redelijke vraag, en er zijn drie hoofdantwoorden.
De eerste heeft te maken met het aanpakken van de oorzaak van de ziekte van Huntington. We weten zeker dat de mutatie in het huntingtine-gen de uiteindelijke reden is waarom mensen HD krijgen. Het DNA aanpakken met zinkvingers betekent het targeten van de bekende oorzaak van de ziekte. Hoewel RNA een essentiële stap is bij het maken van het gemuteerde eiwit, staat het één stap verwijderd van de uiteindelijke oorzaak. Zinkvinger-enthousiastelingen geloven dat het de moeite waard is om te proberen de extra hindernissen van het ontwikkelen van DNA-gerichte medicijnen te overwinnen, vanwege de kans dat het eindresultaat veiliger en effectiever kan zijn.
De tweede betreft RNA. Traditioneel gingen biologen ervan uit dat RNA niet direct nuttige of schadelijke dingen doet – het zit er gewoon en draagt informatie en wordt gelezen door cellulaire machinerie. We weten nu echter dat er meer aan de hand is, en er zijn verschillende genetische ziekten waarbij het RNA direct giftig is voor cellen, in plaats van simpelweg een schadelijke boodschap te dragen.
Hoewel iedereen het erover eens is dat het gemuteerde huntingtine-eiwit de belangrijkste oorzaak van schade is bij de ziekte van Huntington, denken sommige onderzoekers dat huntingtine-RNA een extra bron van schade zou kunnen zijn. Anderen zijn het daar niet mee eens, maar als het RNA schadelijk zou kunnen zijn, lijkt het ideaal om te voorkomen dat het wordt gemaakt, in plaats van het achteraf weg te halen.
De laatste reden gaat over verder gaan dan onderdrukken. Er is meer aan zinkvingers dan het verminderen van genactiviteit. Zodra een zinkvinger een bepaalde DNA-sequentie heeft getarget, zijn er theoretisch veel spannende dingen mogelijk.
Als we vele jaren in de toekomst denken, is het mogelijk dat zinkvingers kunnen worden gebruikt om moleculaire scharen en lijm naar het gemuteerde HD-gen te sturen, om de ongewenste CAG-herhalingen ‘weg te knippen’. Dat staat bekend als genoom-bewerking en het is een van de benaderingen waar Sangamo en anderen in geïnteresseerd zijn om na te streven.
Voor- en nadelen
De meeste HD-onderzoekers waarmee we spreken, zeggen dat zinkvingers een ‘behoorlijk coole’ manier zijn om de ziekte van Huntington te behandelen, en we zijn geneigd het daarmee eens te zijn. HD bestrijden op DNA-niveau, de uiteindelijke oorzaak van het probleem, is zeker iets wat we moeten proberen, en we zijn blij dat er na korte tijd onafhankelijk vooruitgang is gemeld door twee groepen.
Het is belangrijk om in gedachten te houden dat het lang zal duren om deze technieken te verfijnen, die nog in een vroeg stadium van de geneesmiddelenontwikkeling zijn – en zaken zoals genoombewerking zullen decennia nodig hebben om tot bloei te komen voor HD-patiënten.
Ondertussen blijft iedereen in de HD-gemeenschap enthousiast over de lopende wereldwijde inspanningen om huntingtineniveaus te verlagen door zich te richten op het RNA. Die technieken zijn al veel verder gevorderd en zullen zeer binnenkort in menselijke proeven worden getest.
Meer informatie
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…