
Het omleiden van het huntingtine-eiwit in cellen
Canadees team ontcijfert de labels die het huntingtine-eiwit in cellen omleiden, wat helpt verklaren hoe het toxisch wordt

Let op: Automatische vertaling – Mogelijkheid van fouten
Om nieuws over HD-onderzoek en trial-updates zo snel mogelijk onder zoveel mogelijk mensen te verspreiden, is dit artikel automatisch vertaald door AI en nog niet beoordeeld door een menselijke redacteur. Hoewel we ernaar streven om nauwkeurige en toegankelijke informatie te verstrekken, kunnen AI-vertalingen grammaticale fouten, verkeerde interpretaties of onduidelijke formuleringen bevatten.Raadpleeg voor de meest betrouwbare informatie de originele Engelse versie of kom later terug voor de volledig door mensen bewerkte vertaling. Als je belangrijke problemen opmerkt of als je een moedertaalspreker van deze taal bent en wilt helpen met het verbeteren van nauwkeurige vertalingen, voel je dan vrij om contact op te nemen via editors@hdbuzz.net
Het gemuteerde huntingtine-eiwit veroorzaakt de ziekte van Huntington, maar niet al het gemuteerde huntingtine is even toxisch. Precies waar het in cellen wordt gevonden, heeft een grote invloed op of cellen met het gemuteerde eiwit kunnen omgaan. Nieuw onderzoek helpt de signalen te begrijpen die gemuteerd huntingtine door de cel verplaatsen en geeft aanwijzingen over hoe het minder toxisch gemaakt kan worden.
Huntingtine – en zijn boze tweelingbroer
Hoewel de ziekte van Huntington het gevolg is van een genetische afwijking, weten we dat de schade die het veroorzaakt aan cellen te wijten is aan het gemuteerde huntingtine-eiwit. Het HD-gen is een set instructies voor het maken van het huntingtine-eiwit. Bij mensen met HD, en degenen die de ziekte zullen ontwikkelen, zorgt een ‘spelfout’ aan het begin van de genetische instructies ervoor dat een bepaald deel van het eiwit langer is dan normaal. Te veel bouwstenen genaamd ‘glutamine’ zijn aan elkaar geplakt aan één uiteinde van het eiwit.

Het hebben van te veel glutamineblokken aan het begin van het eiwit heeft desastreuze effecten en is verantwoordelijk voor de schadelijke effecten van gemuteerd huntingtine.
Een van de belangrijkste taken van onderzoekers naar de ziekte van Huntington is om precies uit te zoeken hoe het gemuteerde eiwit verschilt van het normale, en hoe die verschillen ervoor zorgen dat het cellen beschadigt. Elk nieuw stukje informatie over de manieren waarop het eiwit schade veroorzaakt, is een mogelijke aanwijzing in de zoektocht naar behandelingen om de ziekte te vertragen.
Ray Truant is een onderzoeker naar de ziekte van Huntington aan de McMaster University in Ontario, Canada. Truant en zijn team van wetenschappers bestuderen het huntingtine-eiwit al jaren en hebben veel belangrijke inzichten gedeeld over hoe het werkt en hoe het misgaat bij de ziekte van Huntington.
Het N-terminale fragment
Huntingtine is een groot eiwit, dus het bestuderen van het hele eiwit tegelijk is moeilijk. Na de ontdekking van het gen in 1993 werd al snel ontdekt dat het meest schadelijke deel van het gemuteerde eiwit zich dicht bij het allereerste begin bevindt. Wetenschappers noemen dit deel van huntingtine, dat de extra glutamines bevat, ‘het N-terminale fragment’.
Naast het kritieke gebied dat gemuteerd is bij HD, heeft dit N-terminale fragment van het huntingtine-eiwit een aantal andere interessante kenmerken. Wetenschappers bestuderen het al bijna 20 jaar en ontdekken nog steeds een aantal onverwachte eigenschappen van dit korte stukje eiwit – eigenschappen die een grote impact hebben op cellen.
Bagageafhandeling in cellen
Het lab van Truant had al ontdekt dat de eerste zeventien aminozuur-bouwstenen van huntingtine bijzonder belangrijk lijken te zijn. Ze gedragen zich een beetje als een ‘adresetiket’ voor het hele eiwit.
Afhankelijk van wat er met een cel gebeurt, kunnen kleine chemische ‘labels’ worden bevestigd aan de eerste zeventien aminozuren, of worden verwijderd. De transportmachinerie van de cel kan deze labels dan lezen als een streepjescode. Afhankelijk van het patroon van aanwezige labels, wordt het huntingtine-eiwit naar verschillende plaatsen in de cel verplaatst. Dus, ondanks het feit dat deze zeventien aminozuren slechts een klein deel van het hele huntingtine-eiwit zijn, kunnen ze een enorme impact hebben op de locatie en functie van het eiwit.
Het toevoegen en verwijderen van deze kleine labels wordt ‘post-translationele modificatie’ genoemd. ‘Translatie’ is het proces van het bouwen van eiwitten met behulp van de DNA-instructies in onze genen, dus ‘post-translationeel’ betekent gewoon ‘nadat het eiwit is gebouwd’.
De magische getallen: dertien en zestien
“Specifieke labels op het dertiende en zestiende aminozuur van huntingtine helpen bepalen of het al dan niet in de celkern terechtkomt.”
Het begrijpen van post-translationele modificatie is echt belangrijk bij HD, omdat het lijkt te beïnvloeden hoe schadelijk het eiwit is. In 2009 ontdekte de groep van William Yang aan UCLA bijvoorbeeld dat het toevoegen van twee van deze labels voorkwam dat HD-modelmuizen symptomen vertoonden. Die labels waren bevestigd aan de dertiende en zestiende aminozuur-bouwstenen van het huntingtine-eiwit.
Aangezien die twee chemische labels cruciaal lijken te zijn voor hoe toxisch het gemuteerde huntingtine-eiwit is, is het belangrijk om ze in meer detail te begrijpen. Het team van Truant ging aan de slag om uit te zoeken wat het effect van die twee labels was op waar het eiwit terechtkwam, en hoeveel schade het daar aanrichtte.
Wat hebben ze ontdekt?
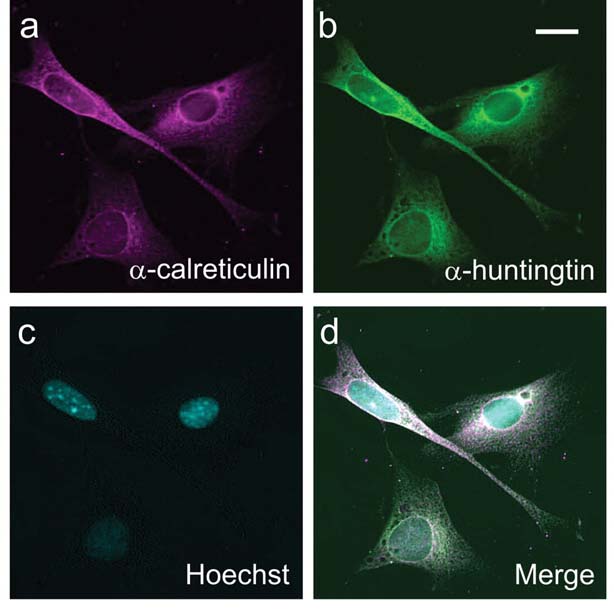
Eerst bestudeerden de onderzoekers het eiwit in levende cellen, groeiend in een schaaltje in het lab. Ze veranderden de cellen genetisch zodat ze alleen de eerste zeventien aminozuur-blokken van het huntingtine-eiwit produceerden, wat ze N17 noemden. Het N17 huntingtine-fragment werd gekoppeld aan een kwalleiwit dat geel oplicht. Dat maakt het mogelijk om het N17-fragment te volgen terwijl het zich door cellen beweegt.
Het team van Truant ontdekte dat wanneer het korte fragment van huntingtine gelabeld was op de cruciale dertiende en zestiende plekken, het veel vaker in de celkern terechtkwam.
De celkern is een heel belangrijk deel van de cel – het is waar het DNA wordt opgeslagen, gekopieerd en gelezen. Veel onderzoekers hebben gesuggereerd dat huntingtine toxischer is voor cellen wanneer het zijn weg naar de celkern vindt. Maar het kan ook schade aanrichten wanneer het buiten de celkern is, dus het is belangrijk om uit te vinden waar het het gevaarlijkst is.
Het team ging verder en toonde aan dat huntingtine op zeer specifieke locaties binnen de celkern wordt gevonden. Ze ontwikkelden ook nieuwe technieken om alleen naar de gelabelde versies van het eiwit te kijken, in plaats van naar alle ongelabelde kopieën die ronddobberen. Deze hulpmiddelen zullen zeer nuttig zijn voor toekomstige studies die de rol onderzoeken die dit labelingsproces speelt bij HD.
Hoe zit het met medicijnen?
Dit werk laat zien dat specifieke labels op het dertiende en zestiende aminozuur van huntingtine helpen bepalen of het al dan niet in de celkern terechtkomt. Het leidt tot het idee dat medicijnen die de labeling van die aminozuren veranderen, de schade aan cellen zouden kunnen verminderen.
Hoe zou zo’n medicijn werken? Of, in de taal van medicijnenjagers, wat zou het ‘doelwit’ zijn?
Wel, de chemische labels worden aan huntingtine bevestigd door eiwitmachinetjes genaamd ‘kinasen’. En ze worden verwijderd door andere machinetjes genaamd ‘fosfatasen’. Kinasen zijn een beetje als nietmachines, terwijl fosfatasen meer lijken op nietjesverwijderaars.
Volgens het werk van Truant zouden medicijnen die de activiteit van de kinase ‘nietmachine’ verminderen, de labels op huntingtine moeten verminderen, waardoor het uit de celkern blijft. De volgende stap zou zijn om te zien waar het eiwit terechtkwam, en of dat het meer of minder toxisch maakte.
Om deze aanpak te testen, gebruikte het team van Truant veel verschillende medicijnen waarvan bekend is dat ze kinasen als doelwit hebben. Deze ‘kinaseremmer’ chemicaliën kunnen wetenschappers helpen om te ontdekken welke specifieke kinase hun favoriete eiwit zou kunnen labelen. Door een bepaalde kinase te blokkeren en vervolgens de nieuwe hulpmiddelen te gebruiken die ze hebben ontwikkeld om naar het gelabelde huntingtine te zoeken, kunnen de onderzoekers ontdekken welke kinasen de labeling uitvoeren.
Na het testen van medicijnen die tachtig verschillende kinasen blokkeren, ontdekte het team dat een bepaalde kinase genaamd ‘caseïne kinase 2’ – of ‘CK2’ – bijzonder belangrijk was. Zoals verwacht zorgden medicijnen die CK2 blokkeerden ervoor dat huntingtine veel minder gelabeld was op de cruciale plekken. Ze hadden het effect dat huntingtine uit de celkern bleef en in plaats daarvan naar het ‘eiwitfabriek’-deel van de cel, het endoplasmatisch reticulum of ‘ER’, werd gestuurd. In het proces werd de schade die het eiwit aan cellen toebracht, vergroot.
Wacht, ze maakten het eiwit MEER toxisch?!
Natuurlijk is een medicijn dat huntingtine meer toxisch maakt precies het tegenovergestelde van wat we bij mensen zouden willen bereiken. Ren dus niet naar de apotheek en vraag niet om een flesje CK2-remmer.
Als dit werk moet leiden tot behandelingen voor patiënten met de ziekte van Huntington, willen we meer gelabeld huntingtine, niet minder. In dit vroege stadium probeerde het team van Truant echter simpelweg uit te vinden welke kinase het krachtigste doelwit was.
Door de zaken in cellen te verergeren met CK2-blokkerende medicijnen, konden ze bevestigen dat CK2 belangrijk is in het labelingsproces waarin we geïnteresseerd zijn. Toekomstig werk kan nu worden gericht op het begrijpen van hoe we het omgekeerde effect kunnen bereiken en huntingtine minder toxisch kunnen maken.
Dit werk, uitgevoerd in cellen in een schaaltje, is nog ver verwijderd van het genereren van behandelingen die bij patiënten kunnen worden gebruikt. Maar het is een belangrijke stap voorwaarts, die ons helpt een van de belangrijkste spelers in de schade aan cellen bij de ziekte van Huntington te begrijpen, en opent een nieuwe deur voor onderzoekers om aan toekomstige behandelingen te werken.
Dit artikel werd op 27 juni bijgewerkt om het effect van labeling en de CK2-blokkerende medicijnen te verduidelijken.
Meer informatie
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


