
De derde dimensie: minibreinen gebruiken om veranderingen in hersenontwikkeling bij de ZvH te begrijpen
Onderzoekers tonen aan dat sterk verlengde CAG’s in het ZvH-gen vroege ontwikkelingsveranderingen kunnen veroorzaken met behulp van 3D-hersenmodellen, organoïden genoemd. Wat ontdekten ze?

Een nieuwe publicatie gebruikte kleine 3D-hersenmodellen gemaakt van menselijke cellen om aan te tonen dat de mutatie die ZvH veroorzaakt tot vroege veranderingen in de hersenontwikkeling kan leiden. Het is echter duidelijk dat ZvH-patiënten volledig volgroeide hersencellen kunnen ontwikkelen die in de meeste gevallen tientallen jaren normaal functioneren. Laten we deze bevindingen in context plaatsen en onderzoeken wat deze ontwikkelingsveranderingen, die zijn ontdekt met menselijke cellen in een kweekschaaltje, kunnen betekenen voor ZvH-patiënten.
Menselijke hersencellen verkrijgen zonder hersenmonsters te verzamelen
Hoewel ZvH uniek is voor mensen, hebben de meeste organismen een versie van het gen dat gemuteerd is om ZvH te veroorzaken – huntingtine, of kortweg Htt. Er kunnen verschillende organismen worden gebruikt voor het bestuderen van ZvH en elk model kan inzicht geven in verschillende aspecten van hoe de ziekte werkt. Als een wetenschapper bijvoorbeeld wil weten of een experimentele behandeling gunstig zou kunnen zijn voor ZvH, kunnen ze fruitvliegen of zelfs wormen gebruiken om die antwoorden te krijgen.

Hoewel vliegen en wormen heel anders zijn dan mensen, hebben ze een zeer korte levensduur (ongeveer 14 dagen voor fruitvliegen) zodat wetenschappers snel hun antwoorden kunnen krijgen. Als ze willen weten wat er in een complexere hersenen zal gebeuren, kiezen wetenschappers vaak voor muizen. Maar om de effecten van hun werk op mensen te begrijpen, moeten wetenschappers hun ideeën testen op mensen – of ten minste menselijke cellen.
In 2006 toonden twee verschillende wetenschappers aan dat je de biologische tijdlijn van een huidcel kunt omkeren, waardoor deze zich kan ontwikkelen tot elk ander celtype in het lichaam. Meer recent zijn zelfs bloedcellen gebruikt. Deze geprepareerde cellen worden “geïnduceerde pluripotente stamcellen” of iPSC’s genoemd.
Als wetenschappers geïnteresseerd zijn in het bestuderen van een hersenziekte zoals ZvH, kunnen ze die iPSC’s omzetten in de gewenste celtypes, zoals neuronen. En nog beter, als de huid- of bloedcellen van een ZvH-patiënt zijn, hebben wetenschappers alles wat ze nodig hebben om de neuronen van die patiënt te bestuderen zonder een hersenmonster te hoeven nemen. Niet alleen supercoole wetenschap, maar ook geweldig nieuws voor ZvH-patiënten, die graag hun hersenen willen behouden!
Meestal worden cellen gekweekt op het platte oppervlak van een petrischaal, maar recent hebben onderzoekers een manier bedacht om iPSC’s te laten groeien in 3-dimensionale celbolletjes – die lijken op een klein brein in een vroeg ontwikkelingsstadium. Deze 3D-structuren worden hersenorganoïden genoemd en zijn vergelijkbaar met een miniatuur hersenmodel.
Het kweken van deze cellen in 3D stelt onderzoekers in staat om te bestuderen hoe ze zich organiseren terwijl het organoïde groeit, wat inzicht geeft in zeer vroege ontwikkelingsgebeurtenissen in de hersenen. Maar hoewel deze kleine hersenachtige structuren vergelijkbare vroege ontwikkelingspatronen lijken te hebben als menselijke hersenen, is het geen werkende replica en hebben ze geen cognitieve functies.
Je bent een prachtige en unieke sneeuwvlok
“In een recent onderzoek werden deze hersenorganoïden gebruikt om de impact van de mutatie die ZvH veroorzaakt op hun ontwikkeling te onderzoeken. Ze deden dit met 4 verschillende cellijnen die in alle opzichten identiek zijn, op één na: het HTT-gen.”
In een recent onderzoek werden deze hersenorganoïden gebruikt om de impact van de mutatie die ZvH veroorzaakt op hun ontwikkeling te onderzoeken. Ze deden dit met 4 verschillende cellijnen die in alle opzichten identiek zijn, op één na: het ZvH-gen. Maar wacht. Hoe kunnen 4 verschillende cellijnen identiek én verschillend zijn?
Je kunt mensen zien als sneeuwvlokken – we zijn allemaal uniek op onze eigen manier, niet alleen met duidelijke fysieke verschillen, zoals verschillende haarkleur of oogvorm, maar ook op genetisch niveau. Iedereen heeft een iets unieke samenstelling in de code van hun DNA die hen anders maakt. Dus terwijl 2 mensen de genetische code kunnen hebben voor handen, kan de een heel lange vingers hebben en de ander korte vingers.
Als onderzoekers cellen nemen van 2 mensen, een met ZvH en een zonder, zullen hun cellen niet alleen de verschillende CAG-lengtes van het HTT-gen van die persoon bevatten, maar ook alle andere genetische verschillen die hen uniek maken! Dit kan de resultaten echter wat verwarrend maken omdat onderzoekers niet weten of eventuele veranderingen die ze meten komen door verschillen in hun ZvH-gen of door een andere unieke verandering in het DNA van die persoon.
Dus terug naar die identiek verschillende cellen – om verwarring in hun onderzoek te voorkomen over of de resultaten komen door verschillende CAG-lengtes in het ZvH-gen of door een andere unieke DNA-code die iemand heeft, gebruikten onderzoekers een reeks cellijnen die afkomstig zijn van één enkele cellijn die genetisch alleen binnen het HTT-gen is aangepast zodat het CAG-herhalingen van verschillende groottes bevat.
In dit geval werd de CAG-herhalingsreeks verhoogd van 30 (om iemand zonder risico op ZvH te vertegenwoordigen) naar 45, 65, of 81 (die respectievelijk volwassen-, adolescent-, of juveniele ZvH vertegenwoordigen) terwijl alle andere genen in deze cellen identiek bleven. Nu kunnen de onderzoekers er zeker van zijn dat alle verschillen die ze waarnemen tussen deze cellijnen expliciet te wijten zijn aan de veranderingen die ze in het ZvH-gen hebben aangebracht. Behoorlijk slim!
Vroeg beginnende juveniele ZvH is mogelijk niet alleen een degeneratieve aandoening
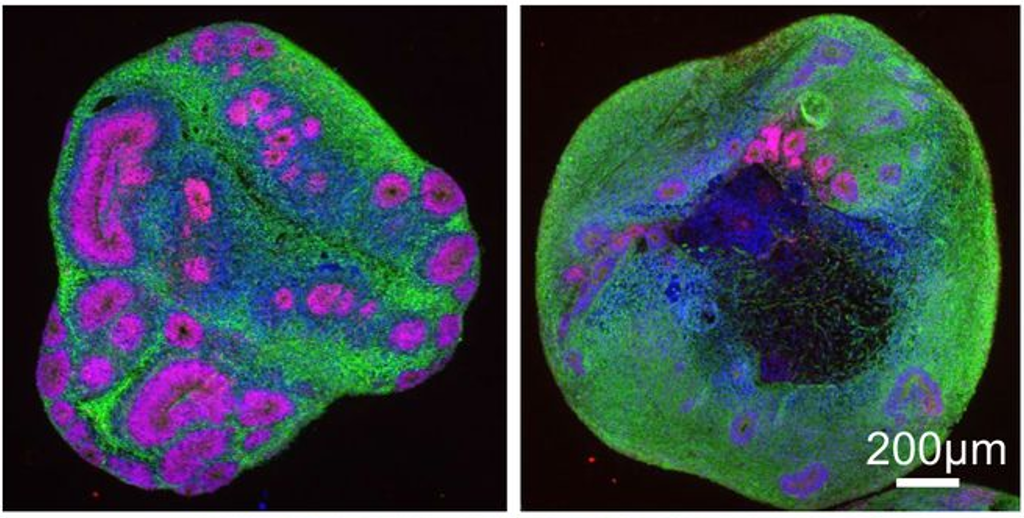
Bij het gebruik van alle 4 cellijnen om organoïden te creëren, merkten de onderzoekers als eerste op dat hoewel organoïden van alle 4 lijnen dezelfde grootte hadden, de ZvH-organoïden kleinere interne structuren ontwikkelden die ontwikkelingsgewijs leiden tot de vorming van belangrijke hersencellen genaamd neuronen, wat suggereert dat de hersenontwikkeling wordt geremd. Dit werd echter alleen waargenomen in organoïden die overeenkomen met adolescente (CAG van 65) en juveniele ZvH (CAG van 81), terwijl de organoïden die volwassen ZvH vertegenwoordigen (CAG van 45) vergelijkbaar waren met de organoïden die iemand zonder ZvH vertegenwoordigen.
Wat betekent dit dus? De auteurs interpreteerden hun bevindingen zo dat de mutatie die ZvH veroorzaakt, vooral in gevallen van juveniele ZvH, de hersenontwikkeling remt. Een alternatief idee is echter dat de mutatie die ZvH veroorzaakt de ontwikkeling mogelijk alleen vertraagt.
Om dit te testen, onderzochten de auteurs oudere organoïden – ze maten het verschil tussen de organoïden met 30 en 81 CAG’s en ontdekten dat ze nog steeds kleinere interne structuren hadden, zelfs op dit latere tijdstip. Het lijkt er dus op dat, ten minste voor juveniele ZvH-gevallen, de hersenontwikkeling in deze organoïden niet alleen vertraagd is, maar eerder vastgelopen. De adolescente en volwassen organoïden waren echter niet opgenomen in dit specifieke experiment.
Een andere belangrijke bevinding uit deze studie suggereert dat de juveniele organoïden zich sneller tot neuronen ontwikkelen dan de organoïden zonder de ZvH-mutatie. Maar als je je ZvH-organoïde literatuur bijhoudt, vind je dit misschien wat verwarrend omdat een artikel dat ongeveer een jaar geleden uitkwam precies het tegenovergestelde vond – dat ZvH-organoïden afgeleid van iPSC’s zich langzamer tot neuronen ontwikkelen dan organoïden zonder ZvH.
Betekent dit dus dat één studie gelijk heeft en de andere fout? Nee. Hoewel de 2 studies tegenovergestelde effecten vonden in de snelheid van ZvH-organoïde neuro-ontwikkeling, werd elke studie iets anders uitgevoerd, met verschillende cellijnen en het meten van effecten op verschillende tijdstippen.
Waar beide studies het over eens zijn, is dat de mutatie die ZvH veroorzaakt leidt tot vroege veranderingen in de neuro-ontwikkeling. Maar alleen omdat resultaten vroege veranderingen in ontwikkeling suggereren, betekent dit niet dat deze veranderingen niet gecompenseerd kunnen worden. De auteurs van de meer recente studie identificeerden zelfs een medicijn dat in staat was om de lagere metingen die ze waarnamen in de juveniele ZvH-organoïden gedeeltelijk te herstellen!
“Waar beide studies het over eens zijn, is dat de mutatie die ZvH veroorzaakt leidt tot vroege veranderingen in de neuro-ontwikkeling. Maar alleen omdat resultaten vroege veranderingen in ontwikkeling suggereren, betekent dit niet dat deze veranderingen niet gecompenseerd kunnen worden.”
Maar hoe zit het met de organoïden die adolescente en volwassen ZvH vertegenwoordigen? Als je oog hebt voor detail, is het je misschien opgevallen dat de meeste bevindingen van deze studie zich alleen richten op organoïden die juveniele ZvH vertegenwoordigen, wat ongeveer 5-10% van de ZvH-patiëntenpopulatie vertegenwoordigt. Dit betekent dat deze experimenten een zeldzame vorm van een al zeldzame ziekte beoordelen. De auteurs van deze studie zijn echter zorgvuldig in het interpreteren van hun bevindingen in de context van wat hun data vertegenwoordigt, en zeggen: “Over het algemeen suggereren deze bevindingen dat ZvH, ten minste in zijn vroeg beginnende juveniele vormen, mogelijk niet alleen een neurodegeneratieve aandoening is en dat abnormale neuro-ontwikkeling een component kan zijn van zijn pathofysiologie”.
Vers van de pers
Een ding om op te merken over deze studie is dat deze momenteel gepubliceerd is in een repository genaamd BioRxiv (uitgesproken als “bio archief”). BioRxiv is een fenomenale bron omdat het data voorafgaand aan publicatie publiceert en voor iedereen beschikbaar is. Hoewel dit de data sneller bij de massa brengt, betekent het ook dat het nog niet het wetenschappelijke proces van “peer review” heeft ondergaan, wat een onbevooroordeelde evaluatie is van het werk door andere wetenschappers in het veld die niet verbonden zijn aan het project.
Peer review is cruciaal voor het handhaven van de nauwkeurigheid van wetenschappelijke studies en biedt de auteurs van het werk een doordacht extern perspectief van andere experts in hun vakgebied. Omdat deze studie nog geen peer review heeft ondergaan, zouden recensenten mogelijk aanvullend werk kunnen vragen vóór publicatie om sommige resultaten te verduidelijken of zelfs verder onderzoek naar de organoïden die adolescente en volwassen ZvH vertegenwoordigen. Je kunt deze studie dus momenteel zien als een onafgemaakt boek – we zullen moeten terugkomen na de definitieve publicatie om het volledige verhaal te krijgen.
Normaliseren deze ontwikkelingsveranderingen ooit?
Hoewel de organoïden heel cool zijn omdat ze ons kunnen vertellen over ZvH-gerelateerde veranderingen op cellulair niveau die vroeg in de ontwikkeling optreden met menselijke cellen, hebben we echt data van patiënten nodig om het effect te interpreteren dat eventuele veranderingen wel of niet kunnen hebben op een volledig ontwikkeld mens.

Een andere studie deed precies dat en onderzocht de groottes van verschillende hersenstructuren van kinderen en adolescenten (6 tot 18 jaar) met en zonder de volwassen vorm van de ZvH-mutatie met behulp van MRI. Dit zijn kinderen zonder symptomen van ZvH, wiens ouders hebben toegestemd om hen te laten deelnemen aan onderzoek om de allereerste veranderingen veroorzaakt door de ZvH-mutatie beter te begrijpen.
Deze studie rapporteerde een grotere striatum (een van de primaire hersengebieden die wordt aangetast door de mutatie die ZvH veroorzaakt) bij ZvH-mutatie-dragende kinderen vroeg, van 6 tot 11 jaar, terwijl ZvH-gen-negatieve kinderen later een grotere striatum hebben, van 11 tot 18 jaar. Het lijkt er dus op dat de gen-positieve kinderen een snellere neuro-ontwikkeling hebben, ten minste van het striatum, maar dat gen-negatieve kinderen uiteindelijk inhalen en eindigen met een grotere striatum op de leeftijden die in deze studie zijn onderzocht. Dit verschil lijkt echter vrij bescheiden, met slechts ongeveer 1mL verschil – ongeveer ¼ van een gummibeer ter vergelijking.
Studies zoals deze die niet-invasieve methoden gebruiken die in staat zijn om zeer kleine veranderingen te detecteren, zijn precies wat nodig is om de bijdrage die ZvH heeft op de hersenontwikkeling te beoordelen. Ze zullen helpen bij het interpreteren van bevindingen uit studies die zeer vroege ontwikkeling vertegenwoordigen, zoals de organoïde studie in een kweekschaaltje, in de context van menselijke patiënten.
Uiteindelijk is onderzoek dat hersenontwikkelingsveranderingen als gevolg van ZvH aantoont nieuw, en hoewel biologisch interessant, weten onderzoekers nog niet wat het allemaal betekent in de context van de ziekte. Het is echter belangrijk om te onthouden dat onderzoekers ook werken aan het ontdekken van mechanismen die eventuele hersenontwikkelingsveranderingen die ze rapporteren kunnen compenseren.
Meer informatie
- Verlengde huntingtine CAG-herhalingen verstoren de balans tussen neurale voorloperexpansie en differentiatie in menselijke cerebrale organoïden (vrij toegankelijk)
- Foutieve neuronale bepaling en celpolarisatie worden teruggedraaid door vroege ZvH-fenotypes te moduleren (volledig artikel vereist betaling of abonnement)
- Abnormale hersenontwikkeling bij kind- en adolescente dragers van gemuteerd huntingtine (volledig artikel vereist betaling of abonnement)
Bronnen & Referenties
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


