
Een krachtige boodschap: veroorzaakt een giftig RNA-boodschappmolecuul schade bij de ziekte van Huntington?
Wat als sommige problemen bij HD te wijten zijn aan iets anders dan een schadelijk eiwit?

Onderzoekers hebben lang geloofd dat het gen voor de ziekte van Huntington problemen veroorzaakt door cellen te vertellen een schadelijk eiwit te maken. Intrigerend nieuw dieronderzoek van onderzoekers in Spanje suggereert dat we misschien naar meer dan één verdachte moeten kijken om de problemen veroorzaakt door de HD-mutatie volledig op te lossen.
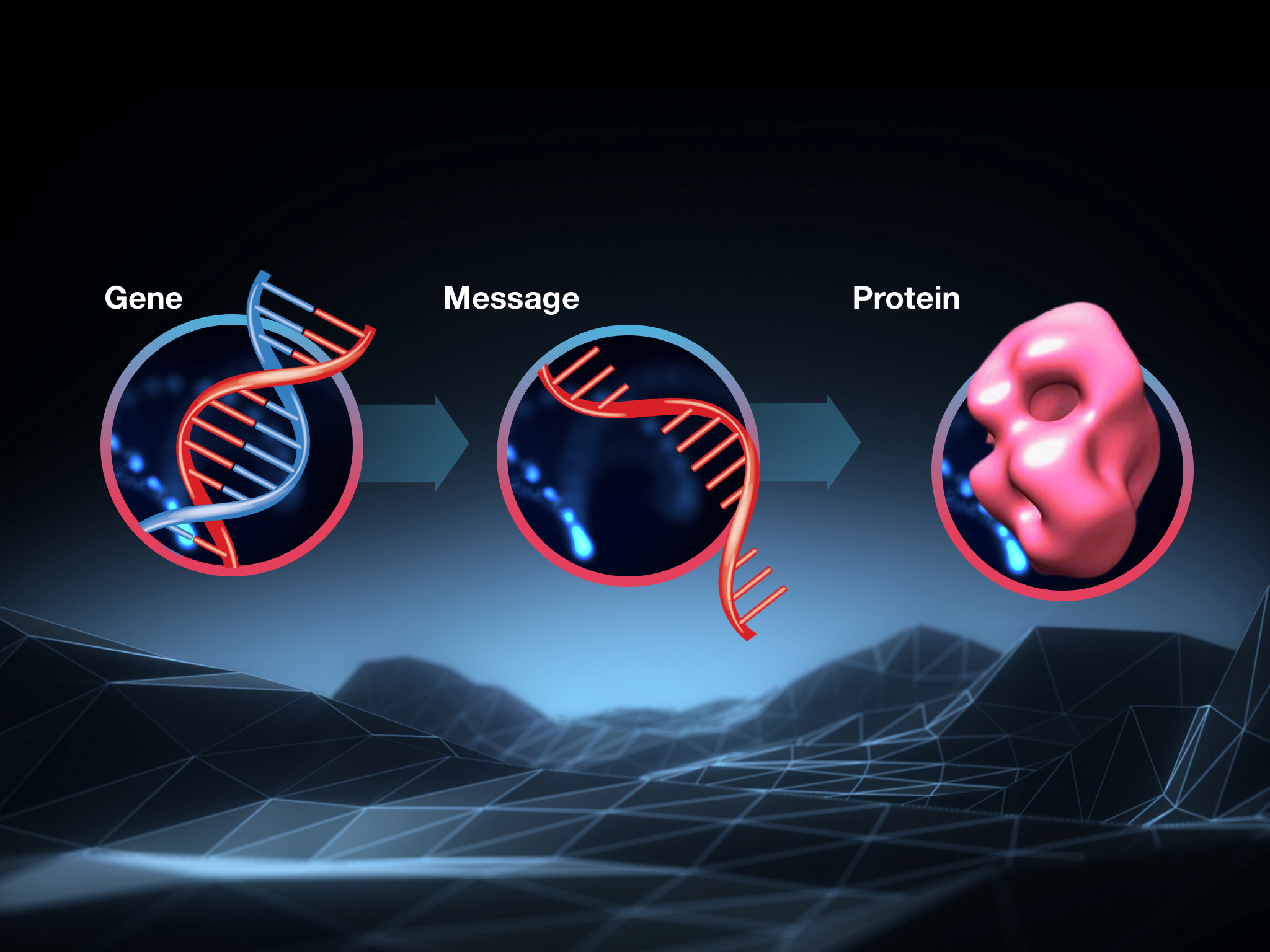
Het centrale dogma van de biologie
Elke patiënt met de ziekte van Huntington draagt dezelfde basale genetische mutatie, geërfd van hun moeder of vader. Deze mutatie bevindt zich in een gen dat we meestal gewoon het HD-gen noemen om het simpel te houden.
De mutatie die HD veroorzaakt is een uitbreiding van een al repetitief stuk DNA in het HD-gen. Nabij het ene uiteinde van het gen vinden we de genetische letters C-A-G keer op keer herhaald. Bij mensen zonder de ziekte van Huntington hebben hun HD-genen ongeveer 20 herhalingen van deze CAG-sequentie. Als je echter een kopie van het HD-gen erft met meer dan 39 herhalingen, zal de ziekte van Huntington zich op een bepaald moment in je leven ontwikkelen.
Genen worden door cellen gebruikt als instructies, of recepten, om eiwitten te maken. Eiwitten zijn de machines die cellen laten werken. Alle coole dingen die onze cellen kunnen doen hangen af van de ingewikkelde interactie van de duizenden verschillende eiwitten die rondschieten en ronddraaien in elke cel.
Tussen de instructies in onze genen en de eiwitten die overal in onze cellen bezig zijn, is er een tussenstap. Omdat DNA zo belangrijk is en koste wat kost beschermd moet worden, kopieert de cel de instructies naar een nieuw molecuul genaamd RNA wanneer een cel een kopie van een specifiek eiwit nodig heeft.
Omdat ze informatie van de ene plaats in de cel naar de andere dragen, noemen wetenschappers deze werkkopieën ‘messenger RNA’ of mRNA.
Wanneer mRNA rondzweeft, zal de cel het lezen en de instructies volgen om het bijbehorende eiwit te maken. Deze volgorde – gen, mRNA, eiwit – is hoe de productie van eiwitten wordt bereikt en gecontroleerd in alle cellen. Het is zo fundamenteel dat het soms het ‘centrale dogma van de biologie’ wordt genoemd.
Wie is de slechterik?
Wie van deze spelers is de slechterik? De meeste wetenschappers die aan HD werken geloven dat het het mutante eiwit is, niet het gen of de boodschapper, dat de meeste problemen veroorzaakt in de cellen van mensen met de Huntington-mutatie. En er is een hoop bewijs dat het eiwit
Bij sommige andere genetische ziekten is het boodschappmolecuul zelf de hoofdoorzaak van problemen. Een voorbeeld is een ziekte genaamd myotonische dystrofie, die ook wordt veroorzaakt door te veel herhalingen van een drieletter genetische sequentie. Bij myotonische dystrofie zorgen boodschapmoleculen met lange herhalingen ervoor dat cellen verkeerd werken en uiteindelijk sterven – het is het mRNA dat de schuld heeft, niet het bijbehorende eiwit.
Er is al lang een groep wetenschappers die geloven dat de boodschapper ook schadelijk zou kunnen zijn bij de ziekte van Huntington. Nieuw werk van een groep in Spanje suggereert dat deze buiten-de-kaders-denkende onderzoekers misschien iets op het spoor zijn.
Vroeg werk in cellen
In 2012 beschreef een groep onderzoekers onder leiding van Eulalia Marti van de Universiteit van Barcelona zeer interessant werk met de HD-gen boodschapper. Ze ontdekten dat boodschapmoleculen van
Dat was verrassend, omdat het team er zorgvuldig voor had gezorgd dat de boodschapmoleculen die ze bestudeerden de cel niet daadwerkelijk konden instrueren om mutant eiwit te maken. Ze deden ook enkele gedetailleerde vervolgexperimenten en identificeerden enkele van de belangrijkste spelers in de cel die ervoor zorgen dat de boodschapper giftig is.
Maar alleen omdat iets kan gebeuren in cellen in een schaaltje, betekent niet dat het wel gebeurt in levende hersenen, dus richtte Marti’s team vervolgens hun aandacht op een muismodel van de ziekte van Huntington, en hersenen van echte HD-patiënten. In zieke gebieden van de hersenen van zowel muizen als mensen vonden ze bewijs van giftige stukjes van het HD-gen boodschappmolecuul. Toen ze zorgvuldig alle eiwitten en andere spullen uit deze echte hersenen elimineerden, waarbij alleen de boodschapmoleculen overbleven, ontdekten ze dat deze boodschapmoleculen gezonde cellen in het lab ziek maakten.
Dit is behoorlijk goed bewijs dat er iets interessants gebeurt met het boodschappmolecuul van het HD-gen, en dat het heel goed mogelijk is dat sommige redenen waarom cellen ziek worden bij HD veroorzaakt kunnen worden door andere dingen dan het mutante eiwit.
“Deze nieuwe studie gebruikt een slimme manier om aan te tonen dat de boodschapper schadelijk zou kunnen zijn, en dat die schade belangrijk zou kunnen zijn.”
Nieuw werk bij muizen
Onlangs heeft Marti’s team een zeer interessante vervolgstudiedie suggereert dat ze misschien iets belangrijks op het spoor zijn gepubliceerd. Deze nieuwe studie gebruikt een slimme manier om aan te tonen dat de boodschapper schadelijk zou kunnen zijn, en dat die schade belangrijk zou kunnen zijn.
Marti en haar team bedachten een manier om te voorkomen dat het HD-gen boodschappmolecuul giftig wordt, zonder de niveaus van het eiwit gemaakt van het HD-gen te veranderen. Met andere woorden, de boodschapper is er nog steeds, en kan nog steeds gelezen worden door de eiwitproducerende machines, maar is niet langer in staat om direct schade te veroorzaken.
Verrassend genoeg vonden ze een manier om precies dit te doen, met behulp van iets dat een antisense oligonucleotide, of ASO wordt genoemd.
Als je al bekend bent met ASO’s, is dat waarschijnlijk omdat ze momenteel getest worden bij menselijke patiënten met de ziekte van Huntington als een mogelijke therapie. Over het algemeen is de taak van ASO’s om hun weg naar cellen te vinden en aan boodschapmoleculen te plakken.
De ASO’s die momenteel bij mensen getest worden, gemaakt door Ionis Pharmaceuticals, plakken aan het HD-gen boodschappmolecuul en richten het op vernietiging. Minder boodschap betekent minder eiwit — en we hopen dat dat cellen zal beschermen tegen schade. De benadering wordt huntingtin-verlaging of soms gen-stillegging genoemd.
Maar de ASO’s gebruikt door Marti en haar collega’s werken op een subtiel andere manier. Ze gaan cellen binnen en vinden het HD-boodschappmolecuul, maar zodra ze het vinden, plakken ze er gewoon aan en blijven daar hangen. Geen vernietiging van de HD-boodschapper, en dus geen verandering in de niveaus van het eiwit dat van de boodschap wordt gemaakt.
Waarom zouden we zo’n nutteloze ASO willen? Omdat Marti’s team ontdekte dat door te binden aan de HD-gen boodschap, de giftige effecten van de boodschap die ze in hun eerdere studie hadden in kaart gebracht werden geblokkeerd. Kortom, ze vonden een heel cool hulpmiddel om het belang van de rol gespeeld door de HD-gen boodschapper te testen.
Toen ze deze speciale ASO in de hersenen van HD-model muizen injecteerden, vonden ze verminderingen in de giftige boodschapper-effecten, maar geen verandering in het HD-eiwit, zoals ze hadden voorspeld. Verrassend genoeg ontdekten ze dat hoewel er nog steeds veel mutant HD-eiwit aanwezig was, de muizen zich veel gezonder gedroegen.
Wat betekent dit allemaal?
Dit is echt coole wetenschap, omdat het zeer zorgvuldig gedaan is en ons eraan herinnert dat we onze aannames over hoe HD werkt moeten blijven bevragen. Elk probleem zo complex als HD heeft waarschijnlijk meerdere oorzaken — en het is volkomen redelijk dat zowel de boodschapper als het eiwit gemaakt van het mutante gen giftig kunnen zijn.
Wat betekent dit voor HD-therapieën, vooral de lopende huntingtin-verlagende proef van ASO’s? We weten het nog niet zeker, maar intuïtief is het logisch dat een ASO van het type dat door Ionis wordt getest gunstig zou moeten zijn voor beide soorten giftige effecten – die veroorzaakt door de boodschap en die veroorzaakt door het eiwit. Van veel andere benaderingen voor huntingtin-verlaging zou ook verwacht worden dat ze de giftige boodschapper en het eiwit wegwerken. En zelfs als een toekomstige behandeling ‘alleen’ de niveaus van het eiwit vermindert, zijn we er nog steeds vrij zeker van dat dat een heel goed ding zou zijn om te doen. Dat is een opluchting!
Nu Marti en haar team de weg hebben gewezen, kunnen onderzoekers in de toekomst controleren hoe elke nieuwe voorgestelde therapie beide mogelijke soorten toxiciteit veroorzaakt door de HD-mutatie beïnvloedt.
Meer informatie
Bronnen & Referenties
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…


