Het verloop van de ziekte van Huntington belicht
Onderzoekers hebben muizen met lichtgevende hersencellen gebruikt om de eerste stappen van neurodegeneratie te ontcijferen
De progressie van de ziekte van Huntington (ZvH) is een lang proces waarbij de eerste veranderingen in de hersenen al plaatsvinden voordat we symptomen bij patiënten zien. Het is logisch om onze inspanningen te richten op het behandelen van de vroegste veranderingen, om het probleem in de kiem te smoren. Maar wat zijn deze veranderingen en hoe kunnen we ze aanpakken? Een recente studie heeft letterlijk licht geworpen op deze vraag. Door ZvH-muizen met lichtgevende hersencellen te creëren, hebben onderzoekers van de Universiteit van Nottingham Medical School en het Babraham Institute in het VK ontdekt dat sommige van de vroegste veranderingen plaatsvinden voordat deze cellen beginnen af te sterven, in een hersengebied waar ZvH-onderzoekers nog nooit eerder aan hadden gedacht.
Zet de magie van gekleurd licht aan
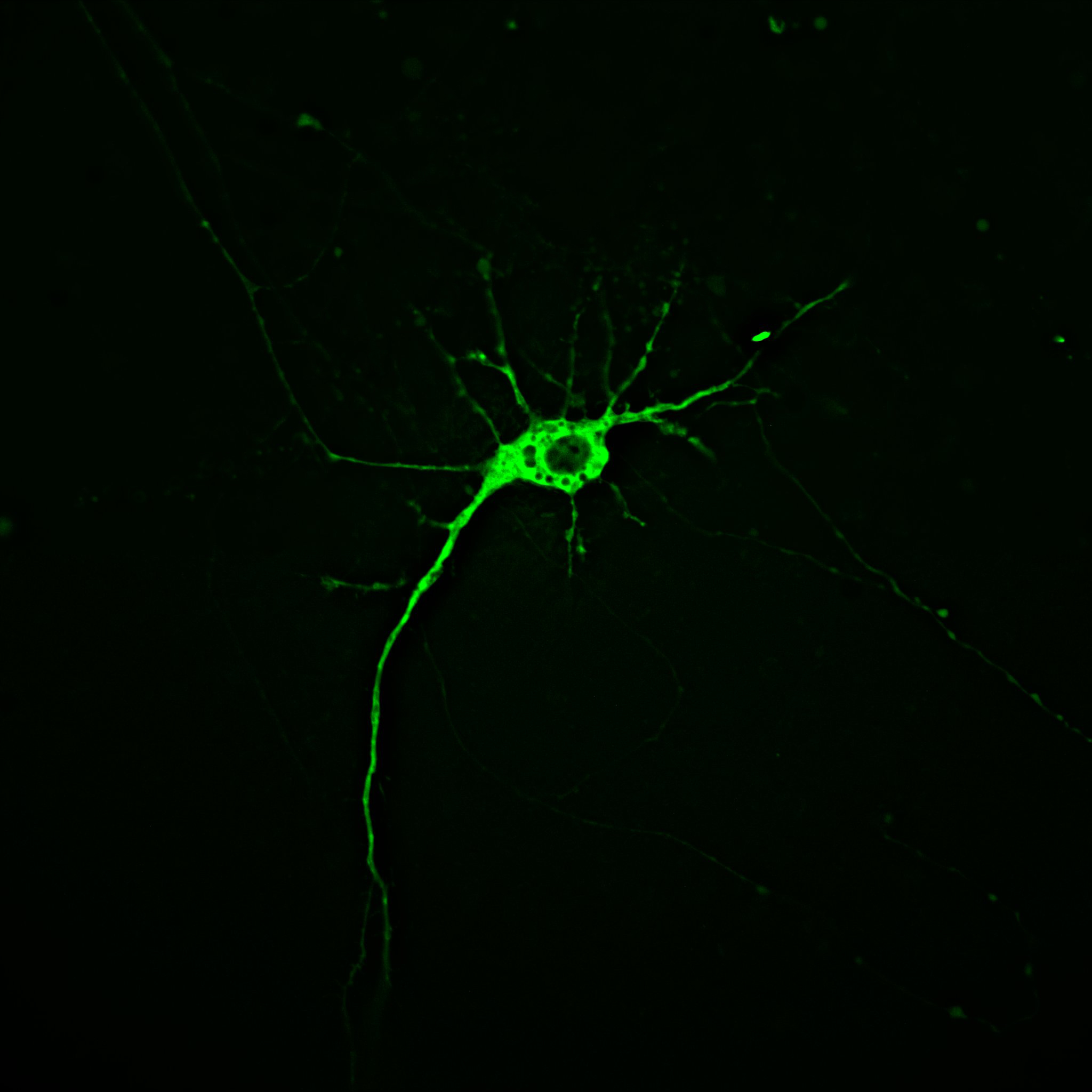
De muizen in kwestie hebben slechts een klein percentage hersencellen, neuronen genoemd, verlicht, en met goede reden. Neuronen kunnen worden gezien als miniatuur informatieverwerkers die inkomende signalen ontvangen bij inputstructuren genaamd “dendrieten”, de informatie verwerken in het cellichaam of “soma”, en het signaal doorgeven via een lange dunne draad genaamd het “axon”.
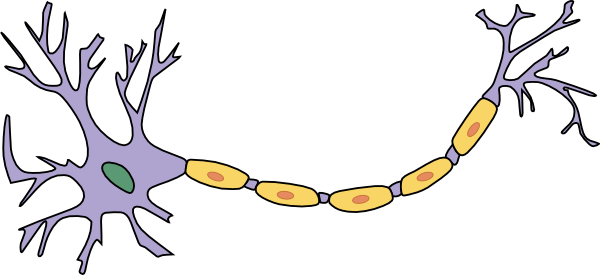
Afbeelding: Quasar Jarosz
De informatie wordt doorgegeven aan de dendrieten van het volgende neuron om boodschappen door te geven in een enorm complex netwerk – boodschappen die al onze gedachten, acties en lichaamsfuncties coördineren. Deze complexiteit betekent dat neuronen dicht op elkaar gepakt zitten tussen allerlei andere cellen en materiaal in de hersenen. Dus, net als bij het nostalgische Lite-Brite speelgoed, maakt het verlichten van een kleine subset van neuronen en de rest donker laten een duidelijk beeld mogelijk.
Een andere reden waarom neuronen moeilijk te bestuderen zijn in de hersenen is dat de “outputdraad” van een neuron, of axon, lange afstanden kan afleggen. De neuronen die je lichaamsbewegingen controleren, bijvoorbeeld, hebben hun soma in de cortex, maar sturen hun axonen helemaal naar beneden tot aan het ruggenmerg. Dat is een lange reis voor een kleine cel!
Door één hele cel te verlichten, kunnen onderzoekers een individueel neuron traceren van zijn dendritische inputpunten, door het soma, langs het axon tot aan zijn eindbestemming in een ander hersengebied. Dit betekent dat ze kunnen onderzoeken of afwijkingen in een axon geassocieerd zijn met veranderingen in de rest van de cel waartoe dat specifieke axon behoort. Weten welk deel van het neuron als eerste ziek wordt, kan wetenschappers helpen begrijpen welke processen als eerste fout gaan bij de ZvH.
De neuronen van twee verschillende ZvH-muismodellen werden op deze manier verlicht: een “transgeen” model en een “knock-in” model. De specifieke transgene muis die ze gebruikten, is genetisch gemanipuleerd om een klein stukje van het gemuteerde ZvH-gen te dragen. De knock-in muis daarentegen heeft de ZvH-veroorzakende expansie “ingeknokt” in zijn natuurlijke muisversie van het huntingtine-gen.
Het belangrijkste verschil tussen deze twee muismodellen is de snelheid en ernst waarmee ze ziek worden. Het transgene model verloopt veel sneller (met symptomen op 12 weken versus 12 maanden), wat voordelig kan zijn, bijvoorbeeld om sneller antwoorden te krijgen over potentiële geneesmiddelen. Het knock-in model doet er veel langer over om ziek te worden en heeft minder drastische (soms moeilijker te meten) symptomen, maar lijkt meer op wat er gebeurt bij ZvH-patiënten, waardoor het een nauwkeuriger model is. Vaak is er in onderzoek een afweging tussen nauwkeurigheid en snelheid, en dat is het geval bij deze twee verschillende modellen.
Zwellingen in de draad
“We moeten nadenken over welke delen van de cel ziek zijn voordat we kunnen nadenken over hoe we ze kunnen behandelen”
Hoewel de ZvH een hersenziekte is, zijn de problemen die bij de ZvH worden gevonden niet gelijkmatig verdeeld over de hersenen. Cellen in bepaalde hersengebieden worden bekend eerder ziek en sterven eerder dan andere. Een klein gebied diep in de hersenen, het “striatum” genoemd, is het meest kwetsbare deel van de hersenen bij de ZvH en verdwijnt bijna volledig tijdens het verloop van de ziekte.
Om dit hersengebied in ZvH-muizen te bestuderen, vergeleek het onderzoeksteam de lichtgevende neuronen in elk model in hun respectievelijke vroege en late stadia van de ziekte. Verrassend genoeg bleken in de transgene muizen de neuronen van het striatum normaal en gezond te zijn, ondanks het feit dat de muizen een aantal symptomen hadden. Dit suggereert dat andere factoren, naast de voor de hand liggende dood of disfunctie van neuronen in het striatum, de ZvH-achtige symptomen moeten veroorzaken die bij deze muizen worden gezien.
Wat betreft het knock-in model, terwijl de muizen in een vroeg stadium normale, gezond ogende hersencellen in hun striatum hadden, vertoonden de muizen in een laat stadium gebieden met bobbelige zwellingen in hun axonen. Axonen, vergeet niet, zijn de transmitterende draad van het neuron, die zijn boodschap overbrengt naar andere cellen in de hersenen.
Axonale zwelling komt van nature voor tijdens veroudering en bij sommige hersenziekten, maar het gebeurde eerder en vaker bij knock-in ZvH-muizen. Het bijbehorende soma (cellichaam) en de dendrieten (inputstructuren) van elk axon zagen er ondertussen nog steeds gezond uit. Dit is erg interessant, omdat het suggereert dat in dit nauwkeurige muismodel veranderingen in het axon als eerste worden gezien.
Als we aannemen dat dit milde muismodel een vroeg stadium vertegenwoordigt van wat er misgaat in de ZvH-hersenen, kunnen deze resultaten ons helpen onze energie te richten op het bestuderen van het juiste deel van het neuron, met name het axon. Er is significant bewijs voor problemen in axonen bij de ZvH, en deze resultaten ondersteunen het idee dat het de moeite waard is om deze problemen te begrijpen bij de ZvH.
De onderzoekers waren echter niet tevreden met het bestuderen van alleen veranderingen in het striatum, ze keken breed naar andere hersengebieden in de hoop andere vroege veranderingen in de ZvH-hersenen te identificeren. Verrassend genoeg was het gebied met de meeste axonale zwelling een structuur in de buurt van het striatum, de stria terminalis genoemd, die betrokken is bij angstgerelateerd gedrag.

Axonen in de stria terminalis vertoonden zwelling zelfs in de vroege stadia van ziekteprogressie, en het werd erger in latere stadia. Opnieuw kon elk aangetaste axon worden getraceerd naar zijn soma (in nog een ander hersengebied genaamd de amygdala), en deze cellichamen waren nog steeds gezond. Dit suggereert dat dit hersengebied ook extra aandacht verdient bij de ZvH.
Een gram op tijd bespaart negen
We worden er nooit moe van om te zeggen dat zelfs genetisch gemodificeerde muizen geen ZvH-patiënten zijn, en geen enkel muismodel zal ons alles kunnen vertellen over wat er gebeurt in de ZvH-hersenen. Maar de resultaten van deze studie vertellen ons dat, in ieder geval in een model dat meer lijkt op de ZvH, axonen degeneratie vertonen voordat de andere neuronendelen dat doen. We moeten nadenken over welke delen van de cel ziek zijn voordat we kunnen nadenken over hoe we ze kunnen behandelen, en hoewel het knock-in muismodel zijn beperkingen heeft, is het een goede plek om axondegeneratie tijdens de ZvH te bestuderen.
Dit werk vertelt ons ook dat de eerste plaats van achteruitgang in de ZvH-hersenen misschien toch niet het striatum is. We missen misschien belangrijke informatie omdat niet alle neuronen van het striatum zichtbaar werden gemaakt door de lichtgevende truc. Maar we hebben zeker een nieuw hersengebied om te verkennen, en als het de openingsscène voor degeneratie blijkt te zijn, dan zal het een aantrekkelijk doelwit zijn voor therapieën die de schade kunnen stoppen voordat deze begint.
Meer informatie
Voor meer informatie over ons openbaarmakingsbeleid, zie onze FAQ…